Derivados del compuesto talidomida conducen a la muerte a células cancerosas resistentes
En las últimas décadas, la medicina ha vuelto a depositar grandes esperanzas en el principio activo
Un estudio de la Universidad Goethe de Frankfurt apunta a la posibilidad de que los derivados de la talidomida sean potencialmente adecuados para tratar el cáncer. La talidomida se comercializó en los años 50 como somnífero. Posteriormente adquirió triste notoriedad por causar graves anomalías fetales en las primeras fases del embarazo. Mientras tanto, se sabe que la molécula marca las proteínas de la célula para su degradación. Para el estudio actual, los investigadores produjeron derivados de la talidomida. Pudieron demostrar que éstos influyen en la degradación de las proteínas responsables de la supervivencia de las células cancerosas.
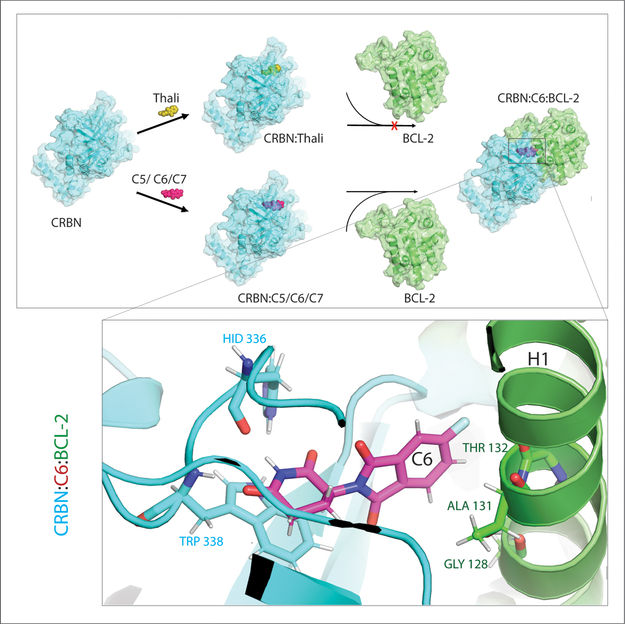
Los derivados de la talidomida C5, C6 y C7 alteran el CRBN -la "máquina de etiquetado"- para que pueda unirse a BCL-2. De este modo, la molécula BCL-2 queda marcada para su degradación - una posible nueva estrategia contra el cáncer.
Dr. Xinlai Cheng, Goethe University Frankfurt
Casi ninguna otra molécula tiene un pasado más turbulento que la talidomida. Fue el ingrediente central de un fármaco aprobado en muchos países en los años 50 como sedante y somnífero. Sin embargo, pronto se hizo evidente que las mujeres embarazadas que habían tomado talidomida a menudo daban a luz niños con graves deformidades.
En las últimas décadas, sin embargo, la medicina ha vuelto a depositar grandes esperanzas en ella. Los estudios han demostrado, entre otras cosas, que inhibe el crecimiento de los vasos sanguíneos y, por tanto, es potencialmente adecuada para cortar el suministro de nutrientes a los tumores. También resultó muy eficaz en el tratamiento del mieloma múltiple, tumores malignos de la médula ósea.
"Ahora sabemos que la talidomida es lo que se denomina un 'pegamento molecular'", explica el Dr. Xinlai Cheng, del Instituto de Química Farmacéutica de la Universidad Goethe de Fráncfort. "Esto significa que es capaz de agarrar dos proteínas y juntarlas". Esto es especialmente interesante porque una de estas proteínas es una especie de "etiquetadora": Pega a la otra proteína una etiqueta inconfundible que dice "RESIDUO".
El sistema de eliminación de residuos de la célula reconoce esta etiqueta: Agarra la molécula de proteína marcada y la tritura. "Es precisamente este mecanismo el que explica los diferentes efectos de la talidomida", afirma Cheng. "Dependiendo de la proteína marcada, puede provocar malformaciones durante el desarrollo embrionario o bien acabar con células malignas".
Este mecanismo abre grandes posibilidades para la medicina, porque las células cancerosas dependen de ciertas proteínas para sobrevivir. Si éstas se pudieran atacar y destruir sistemáticamente, sería posible curar la enfermedad. El problema es que el pegamento molecular es bastante idiosincrásico. Uno de sus socios de unión es siempre la máquina de etiquetado de la célula o, en términos científicos, una E3 ligasa llamada CRBN. Sólo muy pocas de los muchos miles de proteínas del cuerpo entran en cuestión como el otro socio - cuáles exactamente varían de pegamento a pegamento.
"Por eso produjimos una serie de derivados de la talidomida", dice Cheng. "Luego examinamos si tienen propiedades similares a las del pegamento y, en caso afirmativo, contra qué proteínas son eficaces". Para ello, los investigadores añadieron sus derivados a todas las proteínas de una línea celular cultivada. A continuación, controlaron cuáles de estas proteínas se degradaban posteriormente en presencia del CRBN.
"Durante el proceso, identificamos tres derivados capaces de marcar una proteína celular muy importante para la degradación, la BCL-2", explica Cheng. "BCL-2 impide la activación del programa de autodestrucción celular, por lo que si falta, las células perecen". Por eso el BCL-2 lleva tiempo en el punto de mira de la investigación sobre el cáncer. Incluso ya existe un fármaco para tratar la leucemia, llamado venetoclax, que reduce la eficacia de BCL-2 y de este modo provoca la autodestrucción de las células mutadas.
"En muchas células cancerosas, sin embargo, el propio BCL-2 está mutado. En consecuencia, el venetoclax deja de inhibir la proteína", explica Cheng. "Hemos podido demostrar que nuestros derivados también marcan esta forma mutada para su degradación. Además, nuestros socios del Instituto Max Planck de Biofísica simularon en el ordenador la interacción de los derivados de la talidomida con BCL-2. Esto demostró que los derivados se unen a la proteína BCL-2 de forma natural. Esto demostró que los derivados se unen a sitios completamente diferentes que el venetoclax, un resultado que más tarde también pudimos corroborar experimentalmente".
Además, los investigadores probaron sus sustancias en moscas de la fruta con células cancerosas. La tasa de supervivencia de las moscas así tratadas fue mucho mayor. Sin embargo, Cheng advierte que no hay que hacerse demasiadas ilusiones, ya que estos resultados no dejan de ser investigación básica: "Aunque demuestran que las moléculas modificadas de talidomida tienen un gran potencial terapéutico, aún no podemos decir si realmente se demostrarán en la práctica en algún momento".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.





















































