Pequeña proteína, gran impacto
Una pequeña proteína actúa como alarma sensible para que las bacterias estén alerta ante los péptidos antimicrobianos
La naturaleza utiliza los péptidos antimicrobianos como antibióticos de amplio espectro: Constituyen la primera línea de defensa contra los patógenos invasores. Las bacterias, por su parte, han desarrollado formas de burlar estas defensas. Microbiólogos del Instituto Max Planck de Marburgo han investigado cómo una pequeña proteína permite a las bacterias reconocer sensiblemente los péptidos antimicrobianos y defenderse eficazmente. Su estudio sienta las bases moleculares para el desarrollo de nuevos agentes basados en péptidos.
Las proteínas pequeñas suelen tener menos de 50 aminoácidos de longitud. Debido a su pequeño tamaño, en el pasado han pasado desapercibidas. Los avances en bioinformática y perfiles ribosómicos han revelado que en bacterias, arqueas, eucariotas y comunidades microbianas se producen entre cientos y miles de proteínas pequeñas. Los estudios han demostrado que funcionan principalmente como reguladores de diversos procesos y vías biológicos.
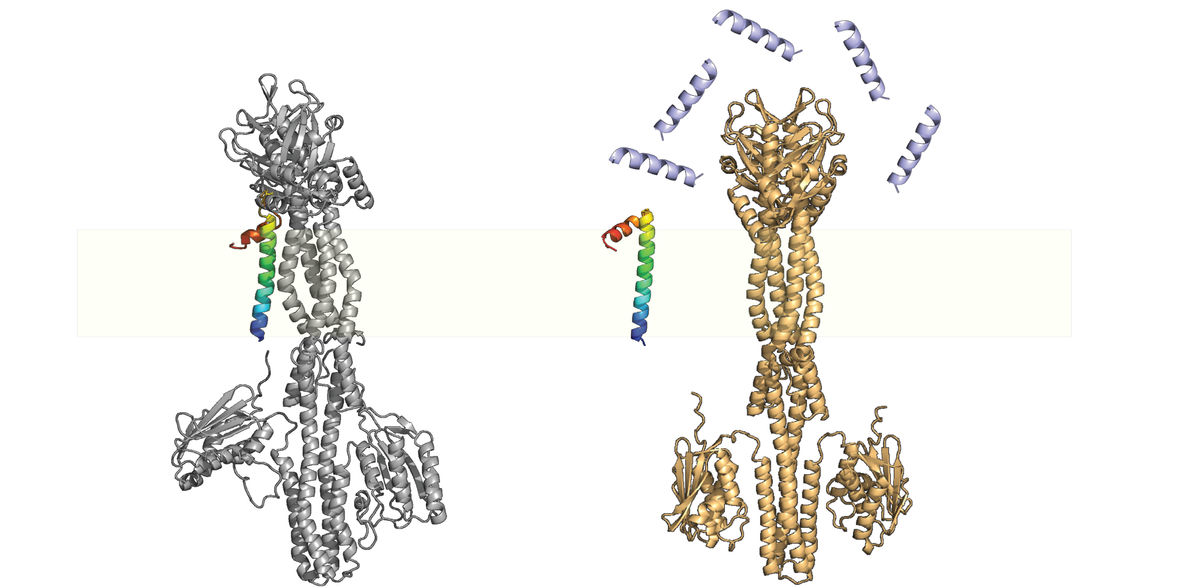
La Dra. Jing Yuan, jefa del grupo del proyecto en el Instituto Max Planck de Microbiología Terrestre, llama a las proteínas pequeñas "los artilugios de la naturaleza". Entre otras cosas, su equipo estudia una importante proteína pequeña llamada MgrB. Esta proteína está ampliamente distribuida en las enterobacterias e interactúa con un sensor quinasa llamado PhoQ, una proteína unida a la membrana que detecta señales ambientales asociadas al huésped, como la limitación de magnesio, la disminución del pH, el aumento de la osmolaridad, los ácidos grasos insaturados de cadena larga procedentes de la bilis y los péptidos antimicrobianos. Con un sistema PhoQ/PhoP que funcione correctamente, las bacterias patógenas pueden activar el programa de virulencia y evadir el sistema inmunitario dentro del hospedador mamífero en el momento y lugar adecuados. El sistema de dos componentes PhoQ/PhoP es, por tanto, un regulador maestro del programa de virulencia, y la interacción de MgrB afecta a la virulencia bacteriana, la aptitud y la resistencia a los fármacos. ¿Pero cómo exactamente?
Cuando las bacterias invaden el hospedador, el sistema PhoQ/PhoP se activa debido a la concentración fisiológica relativamente baja de magnesio, que induce entonces la expresión de mgrB, dando lugar a un sistema PhoQ/PhoP parcialmente reprimido. En presencia de péptidos antimicrobianos (por ejemplo, en la capa de mucosa intestinal o en el interior de los macrófagos), MgrB se disocia de PhoQ, libera el efecto inhibidor y desencadena la activación completa de la vía PhoQ/PhoP.
El equipo de investigadores, junto con colegas de la Universidad de Berna (Suiza), ha demostrado ahora que la inhibición de PhoQ por parte de MgrB estabiliza el sistema al proporcionar una retroalimentación negativa. Sin MgrB, el sistema PhoQ/PhoP es hiperactivo y deja de ser sensible a niveles subinhibitorios de péptidos antimicrobianos.
"Es como una persona que lanza puñetazos en la oscuridad, sin saber si es seguro o si hay un ataque", afirma Jing Yuan. "Nuestros resultados demuestran lo importante que puede ser una proteína tan pequeña para la aptitud bacteriana y la resistencia a los fármacos "Además, también proporciona la base molecular para la ingeniería de nuevos reguladores basados en péptidos para controlar la virulencia bacteriana y la resistencia a los fármacos."
Modificando las propiedades de la MgrB, el grupo de Yuan está desarrollando nuevos reguladores peptídicos que denominan Super-MgrBs. Se espera que los Super-MgrB se unan permanentemente a PhoQ, inhibiéndola. Esto suprimiría por completo el sistema PhoQ/PhoP y mantendría el programa de defensa bacteriano en estado de desconexión. La hipótesis de los investigadores es que las super-MgrBs podrían impedir el reconocimiento de los péptidos antimicrobianos, haciendo más vulnerables a las bacterias patógenas.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.