Un nuevo avance en la microscopía de fluorescencia de superresolución
Rapidez incluso a nivel nanométrico
Científicos del Instituto Max Planck de Investigación Médica de Heidelberg, dirigido por el Premio Nobel Stefan Hell, han desarrollado un microscopio de superresolución con una precisión espaciotemporal de un nanómetro por milisegundo. Una versión mejorada de su microscopio de superresolución MINFLUX, presentado recientemente, permitió observar con un nivel de detalle sin precedentes los movimientos diminutos de proteínas individuales: el movimiento de paso de la proteína motora kinesina-1 a medida que camina por los microtúbulos mientras consume ATP. El trabajo pone de relieve la potencia del MINFLUX como nueva herramienta revolucionaria para observar cambios conformacionales de tamaño nanométrico en las proteínas. El trabajo se ha publicado recientemente en Science.
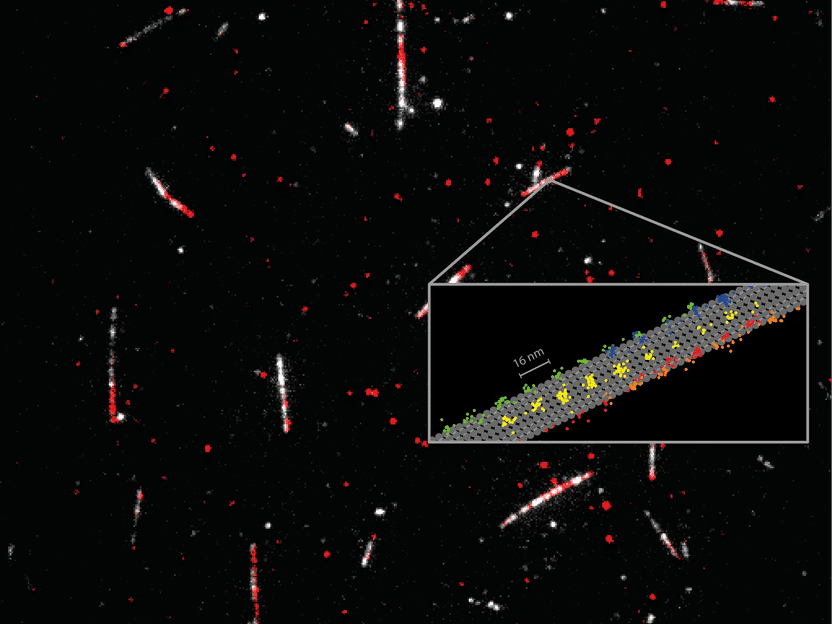
Medición detallada de cómo la proteína motora kinesina-1 (rojo) camina sobre los microtúbulos (blanco). El seguimiento de los movimientos 2D de dímeros individuales de kinesina-1 (codificados por colores en el esquema) a concentraciones fisiológicas de ATP reveló detalles clave de cómo camina la proteína en carriles individuales. El MINFLUX facilitó el seguimiento cercano al protofilamento de la proteína motora en el microtúbulo (esbozado en gris) y pone de relieve la eficacia del MINFLUX como herramienta para el seguimiento de cambios conformacionales en proteínas.
MPI for Medical Research
Para desentrañar el funcionamiento interno de una célula es preciso conocer la bioquímica de cada proteína. Medir los minúsculos cambios en su posición y forma es el reto principal. La microscopía de fluorescencia, en particular la microscopía de superresolución (es decir, la nanoscopía), se ha hecho indispensable en este campo emergente. MINFLUX, el sistema de nanoscopia de fluorescencia recientemente introducido, ya ha alcanzado una resolución espacial de uno a unos pocos nanómetros: el tamaño de las pequeñas moléculas orgánicas. Sin embargo, para avanzar en el conocimiento de la fisiología celular molecular es necesario realizar observaciones con una resolución espaciotemporal aún mayor.
Aumentar la potencia del MINFLUX
Cuando el grupo de Stefan Hell presentó por primera vez MINFLUX en 2016, se había utilizado para rastrear proteínas marcadas con fluorescencia en las células. Sin embargo, estos movimientos eran aleatorios, y el seguimiento tenía precisiones del orden de decenas de nanómetros. Su estudio, publicado esta semana en Science, es el primero en aplicar el poder de resolución de MINFLUX a los cambios conformacionales de las proteínas, concretamente de la proteína motora kinesina-1. Para ello, los investigadores del MPI for Medical Research desarrollaron una nueva versión de MINFLUX para el seguimiento de moléculas fluorescentes individuales.
Todos los métodos establecidos para medir la dinámica de las proteínas tienen graves limitaciones, lo que dificulta su capacidad para abordar el importantísimo intervalo de (sub)nanómetros / (sub)milisegundos. Algunos ofrecen una alta resolución espacial, de hasta unos pocos nanómetros, pero no pueden seguir los cambios con la suficiente rapidez. Otros tienen una alta resolución temporal, pero requieren el marcaje con microesferas que son de 2 a 3 órdenes de magnitud mayores que la proteína estudiada. Dado que es probable que el funcionamiento de la proteína se vea comprometido por una microesfera de este tamaño, los estudios que utilizan microesferas dejan preguntas abiertas. MINFLUX, sin embargo, sólo requiere una molécula de fluorescencia estándar de 1 nm como etiqueta unida a la proteína y, por tanto, puede proporcionar tanto la resolución como la invasividad mínima que se necesitan para estudiar la dinámica de las proteínas nativas. "Uno de los retos consiste en construir un microscopio MINFLUX que funcione cerca del límite teórico y esté protegido contra el ruido ambiental", explica Otto Wolff, estudiante de doctorado del grupo. "Otro es diseñar sondas que no afecten a la función de la proteína, pero que revelen el mecanismo biológico", añade su colega Lukas Scheiderer.
El microscopio MINFLUX que introducen ahora los investigadores puede registrar los movimientos de las proteínas con una precisión espaciotemporal de hasta 1,7 nanómetros por milisegundo. Requiere la detección de sólo unos 20 fotones emitidos por la molécula fluorescente.
"Creo que estamos abriendo un nuevo capítulo en el estudio de la dinámica de las proteínas individuales y de cómo cambian de forma durante su funcionamiento", afirma Stefan Hell. "La combinación de alta resolución espacial y temporal que proporciona MINFLUX permitirá a los investigadores estudiar las biomoléculas como nunca antes".
Resolución del movimiento escalonado de la kinesina-1 con ATP en condiciones fisiológicas
La kinesina-1 es un actor clave en el transporte de carga a través de nuestras células, y las mutaciones de la proteína están en el corazón de varias enfermedades. En realidad, la kinesina-1 "camina" a lo largo de filamentos (los microtúbulos) que se extienden por nuestras células como una red de calles. Se puede imaginar el movimiento como si literalmente "pisara", ya que la proteína tiene dos "cabezas" que cambian alternativamente su ubicación en el microtúbulo. Este movimiento se produce normalmente a lo largo de uno de los 13 protofilamentos que forman el microtúbulo, y se alimenta de la división del principal proveedor de energía de la célula, el ATP (trifosfato de adenosina).
Utilizando un único fluoróforo para marcar la kinesina-1, los científicos registraron los pasos regulares de 16 nm. de las cabezas individuales, así como subpasos de 8 nm, con una resolución espaciotemporal de nanómetros/milisegundos. Sus resultados demostraron que el ATP se absorbe mientras una sola cabeza está unida al microtúbulo, pero que la hidrólisis de ATP se produce cuando ambas cabezas están unidas. También revelaron que el paso implica una rotación del "tallo" proteico, la parte de la molécula de kinesina que sostiene la carga. La resolución espaciotemporal de MINFLUX también reveló una rotación de la cabeza en la fase inicial de cada paso. Cabe destacar que estos hallazgos se realizaron utilizando concentraciones fisiológicas de ATP, algo que hasta ahora no era posible con etiquetas de fluorescencia diminutas.
Futuro potencial en la exploración de la dinámica de proteínas
"Estoy entusiasmado por ver adónde nos llevará MINFLUX. Añade otra dimensión al estudio del funcionamiento de las proteínas. Esto puede ayudarnos a comprender los mecanismos que subyacen a muchas enfermedades y, en última instancia, contribuir al desarrollo de terapias", añade Jessica Matthias, una científica postdoctoral del antiguo grupo de Hell que ahora explora las aplicaciones del MINFLUX a diversas cuestiones biológicas.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.