Cómo los gérmenes resistentes transportan las toxinas a nivel molecular
Los resultados podrían ayudar a desarrollar mecanismos para combatir patógenos peligrosos
Para contrarrestar la creciente amenaza que suponen los gérmenes multirresistentes, debemos entender cómo funcionan sus mecanismos de resistencia. Las proteínas de transporte desempeñan un papel importante en este proceso. En un artículo publicado en la revista Nature Communications, un equipo de investigación alemán y británico dirigido por la Universidad Heinrich Heine de Düsseldorf (HHU) ha descrito ahora la estructura tridimensional de la proteína de transporte Pdr5, que también se encuentra de forma similar en los hongos patógenos. Los resultados podrían ayudar a desarrollar mecanismos para combatir patógenos peligrosos.
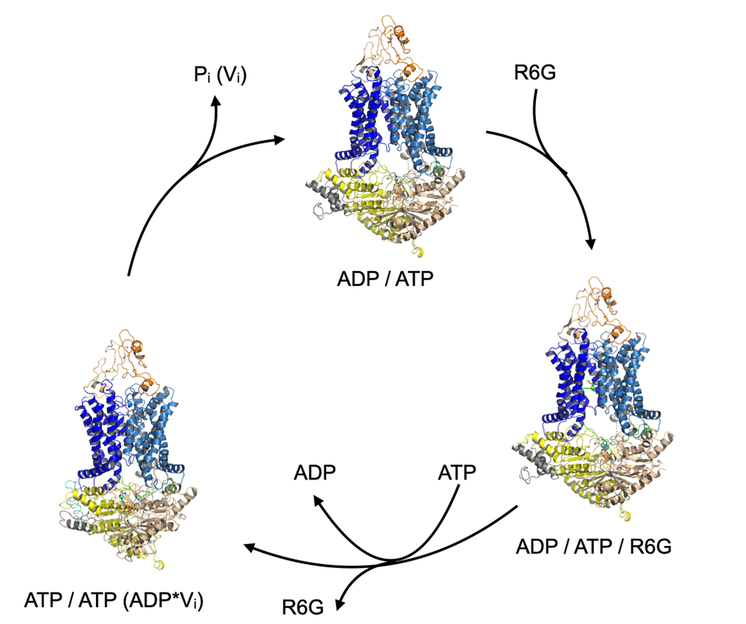
Ciclo de transporte del transportador ABC Pdr5 (naranja / azul / amarillo). Completa el ciclo mediante la unión e hidrólisis de ATP a ADP. El sustrato R6G (verde) se une en un punto determinado del ciclo y se libera de nuevo en un paso posterior.
HHU / Lutz Schmitt
La resistencia de los microorganismos a los antibióticos, en particular, es un problema importante en la medicina cotidiana. Esto ha hecho que el número de microbios resistentes aumente exponencialmente. Como consecuencia, infecciones que parecían ya erradicadas con los fármacos modernos vuelven a suponer una amenaza potencialmente mortal para el ser humano. La situación se complica aún más por el hecho de que cada vez aparecen más gérmenes resistentes no a uno, sino a varios antibióticos u otros fármacos.
Se están investigando los mecanismos que utilizan los microbios para defenderse de las sustancias tóxicas para ellos. Uno de los métodos consiste en transportar activamente las sustancias tóxicas fuera de la célula antes de que puedan causar algún daño. Para ello, los microbios utilizan proteínas especiales de transporte de membrana. En particular, en los microbios eucariotas, como los hongos, que tienen un núcleo celular -a diferencia de las bacterias, que no lo tienen-, estas proteínas de membrana forman parte de la familia de los transportadores ABC ("ATP-binding cassette"). Exportan las sustancias tóxicas desdoblando el transportador celular de energía ATP.
En una publicación actual en Nature Communications, un equipo de investigación alemán y británico dirigido por el Prof. Dr. Lutz Schmitt, del Instituto de Bioquímica de la HHU, ha presentado la estructura tridimensional del transportador ABC de levadura Pdr5 en varios estados funcionales. Para determinar estas estructuras utilizaron la criomicroscopía de una sola partícula, que permite examinar en particular moléculas biológicas en su forma natural con una resolución muy alta mediante la congelación instantánea a bajas temperaturas.
El equipo de investigación no sólo demostró que Pdr5 es una proteína de transporte central en la creación de la resistencia conferida por la proteína de membrana, sino que también utilizó las estructuras resueltas para localizar el sitio de unión al fármaco y definir el ciclo de transporte.
Durante más de 30 años, Pdr5 ha constituido el modelo de las proteínas PDR en hongos patógenos como Candida albicans, causante de la candidiasis. Los nuevos hallazgos ayudan a explicar qué es lo que permite, a nivel molecular, que una sola proteína de membrana impida la entrada de moléculas estructuralmente diversas en la célula o las transporte fuera de ella de forma eficiente. Los hallazgos pueden servir ahora de base para diseñar nuevos fármacos de forma selectiva para contrarrestar la resistencia.
El grupo de trabajo del profesor Schmitt lleva casi 20 años investigando para explicar el funcionamiento de la proteína transportadora. Los investigadores lograron comprender la estructura gracias a la colaboración con el grupo del Prof. Dr. Ben Luisi en el Departamento de Bioquímica de la Universidad de Cambridge. En la HHU, la investigación también contó con la participación del grupo de trabajo del Prof. Dr. Holger Gohlke del Instituto de Química Farmacéutica y Medicinal y del Centro de Estudios Estructurales (dirigido por el Dr. Sander Smits).
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.