Metabolismo: Los investigadores arrojan por primera vez luz sobre la estructura de un enorme complejo enzimático
Un nuevo método ha permitido desvelar la estructura natural de enzimas especialmente grandes y complejas
Científicos de la Universidad Martin Luther de Halle-Wittenberg (MLU) y de la Universidad Técnica de Berlín han publicado sus hallazgos en la revista "Cell Reports". Han investigado un complejo multienzimático que desempeña un papel esencial en el metabolismo y han descubierto que funciona de forma diferente a lo que se pensaba. Esto ayudará a los científicos a comprender mejor ciertas enfermedades.
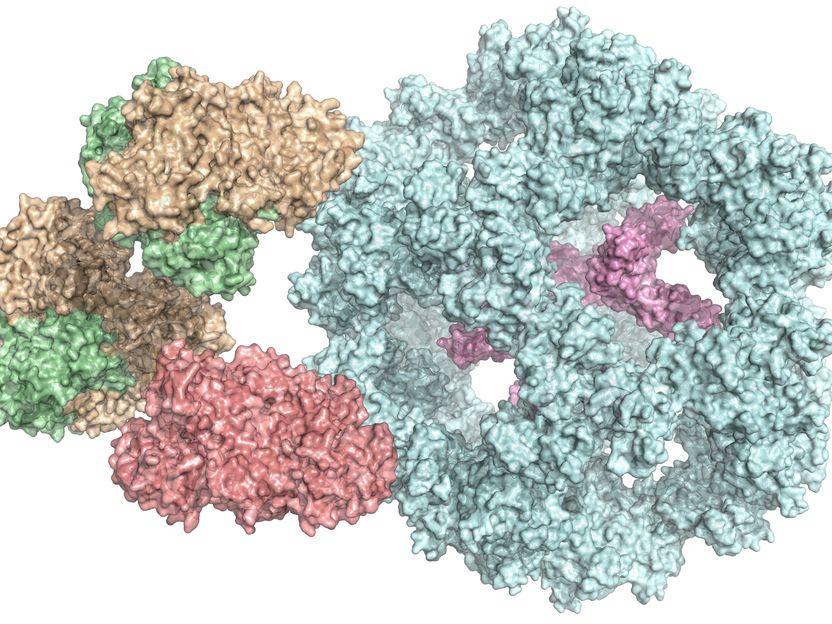
El complejo de la piruvato deshidrogenasa está formado por muchas enzimas diferentes (marcadas en distintos colores).
Panagiotis Kastritis
Las enzimas son los biocatalizadores de una célula. Aceleran las reacciones químicas en el organismo o se encargan de que éstas se produzcan. Por ello, desempeñan un papel muy importante en el metabolismo. Las enzimas individuales suelen formar un complejo con muchas subunidades, como es el caso del complejo de la piruvato deshidrogenasa. Está presente en todas las células humanas, animales y vegetales, así como en los hongos e incluso en algunas bacterias. "Es vital para la producción de energía en las células", explica el Dr. Panagiotis Kastritis, profesor adjunto de la MLU y jefe de grupo del Centro de Competencia en Innovación HALOmem.
"Hasta ahora, el complejo enzimático siempre se ha descompuesto en sus partes individuales antes de ser examinado. Estudiar el complejo funcional completo es muy complicado", afirma Kastritis. Para resolver este problema, su equipo combinó varios métodos de investigación bioquímica y biofísica. Además de utilizar la espectrometría de masas y los análisis químicos, una forma especial de microscopía electrónica -la criomicrografía- ha sido esencial para estudiar una estructura tan compleja, dice el biólogo estructural. Permite observar estructuras orgánicas complejas con una alta resolución y en su estado natural. "Sin embargo, es muy importante reunir posteriormente todos estos datos en modelos informáticos", dice Kastritis. Para el estudio actual, el equipo de investigadores utiliza extractos celulares de un hongo que puede sobrevivir a altas temperaturas, lo que facilita el análisis.
De este modo, los científicos han logrado comprender cómo interactúan entre sí las distintas subunidades del complejo enzimático y también han descubierto que funciona de forma diferente a lo que se suponía hasta ahora. "Antes se pensaba que todas las subunidades participaban directamente en la reacción", dice Kastritis. "Pero ahora sabemos que algunas de ellas parecen formar una especie de cámara que protege la reacción". Dado que los complejos son muy similares en todos los organismos, los resultados también están ayudando a los investigadores a comprender el complejo de la piruvato deshidrogenasa humana.
El nuevo método podría ayudar a los científicos a comprender mejor muchas enfermedades diferentes. Algunos virus, por ejemplo, reducen el número de asociaciones enzimáticas en las células. Este efecto también se ha observado en la enfermedad de Alzheimer. En algunos casos, sin embargo, las enzimas no funcionan correctamente y las reacciones vitales se producen con demasiada lentitud o rapidez. "Si somos capaces de comprender mejor la estructura natural, podremos reconocer pequeños cambios y entender por qué la reacción ya no se produce como debería", afirma Kastritis. En teoría, este conocimiento también podría servir de base para nuevas opciones de tratamiento.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.