La investigación expone una nueva vulnerabilidad para el SARS-CoV-2
Las interacciones electrostáticas mejoran la unión de la proteína de punta con las células anfitrionas
Los investigadores de la Universidad de Northwestern han descubierto una nueva vulnerabilidad en la infame proteína de punta del coronavirus, iluminando un camino de tratamiento potencial relativamente simple.
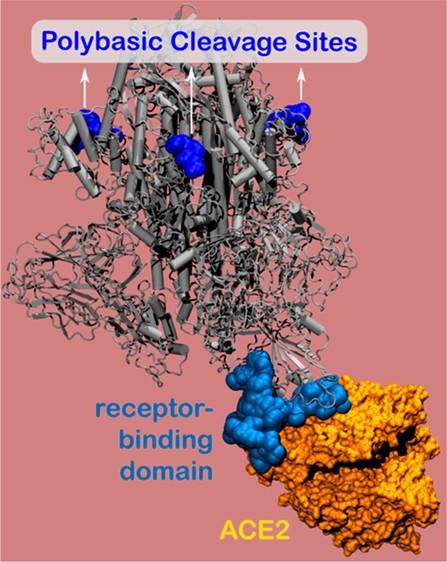
Un modelo computarizado que muestra los sitios de ruptura polibásica, ubicados en el nuevo pico de proteína del coronavirus.
Northwestern University
La proteína de la espina contiene el sitio de unión del virus, que se adhiere a las células huésped y permite que el virus entre e infecte el cuerpo. Utilizando simulaciones a nivel nanométrico, los investigadores descubrieron un sitio con carga positiva (conocido como el sitio de división polibásica) situado a 10 nanómetros del sitio de unión real de la proteína punta. El sitio con carga positiva permite una fuerte unión entre la proteína del virus y los receptores de las células humanas con carga negativa.
Aprovechando este descubrimiento, los investigadores diseñaron una molécula cargada negativamente para unirse al sitio de división cargado positivamente. Bloquear este sitio inhibe al virus de unirse a la célula anfitriona.
"Nuestro trabajo indica que bloquear este sitio de división puede actuar como un tratamiento profiláctico viable que disminuye la capacidad del virus para infectar a los seres humanos", dijo Mónica Olvera de la Cruz de Northwestern, quien dirigió el trabajo. "Nuestros resultados explican los estudios experimentales que muestran que las mutaciones de la proteína de punta del SARS-CoV-2 afectaron la transmisibilidad del virus".
La investigación fue publicada en línea la semana pasada en la revista ACS Nano. Olvera de la Cruz es el abogado Taylor profesor de Ciencia de Materiales e Ingeniería en la Escuela de Ingeniería McCormick de Northwestern. Baofu Qiao, un profesor asistente de investigación en el grupo de investigación de Olvera de la Cruz, es el primer autor del artículo.
Compuesto de aminoácidos, los sitios de ruptura polibásica del SARS-CoV-2 han permanecido esquivos desde que comenzó el brote de COVID-19. Pero investigaciones anteriores indican que estos misteriosos sitios son esenciales para la virulencia y la transmisión. Olvera de la Cruz y Qiao descubrieron que el sitio de división polibásica se encuentra a 10 nanómetros de los receptores de células humanas, un hallazgo que proporcionó una visión inesperada.
"No esperábamos ver interacciones electrostáticas a 10 nanómetros", dijo Qiao. "En condiciones fisiológicas, todas las interacciones electrostáticas ya no se producen a distancias superiores a 1 nanómetro".
"La función del sitio de división polibásica ha permanecido esquiva", dijo Olvera de la Cruz. "Sin embargo, parece estar escindido por una enzima (furina) que abunda en los pulmones, lo que sugiere que el sitio de división es crucial para la entrada del virus en las células humanas".
Con esta nueva información, Olvera de la Cruz y Qiao planean trabajar con químicos y farmacólogos del noroeste para diseñar una nueva droga que pueda unirse a la proteína espiga.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.