Fibres dites superspreaders observées en action
Dans les maladies de démence comme la maladie d'Alzheimer, des protéines mal pliées s'accumulent dans le cerveau. Des chercheurs de l'Empa ont maintenant mis en évidence une espèce particulièrement active de fibres protéiques avec une précision inédite. Ils ont pu suivre au microscope le processus de formation de molécules potentiellement toxiques à la surface des fibres pendant des heures.

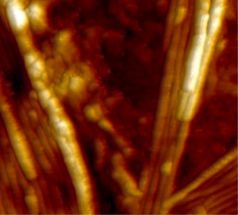
Structures protéiques hautement actives sous le microscope à force atomique : les zones claires indiquent l'activité particulièrement élevée des fibrilles d'une épaisseur de l'ordre du nanomètre.
Empa
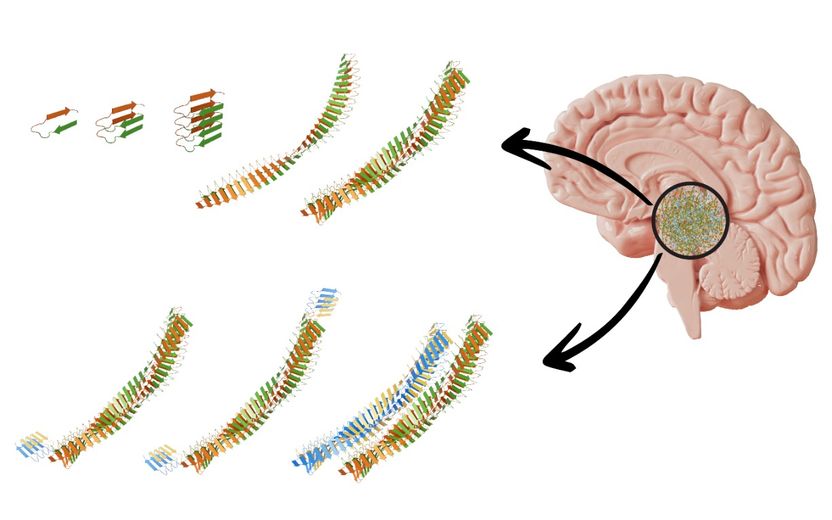
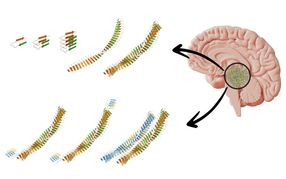
Représentation schématique de la formation des fibrilles dites superspreaders.
Empa
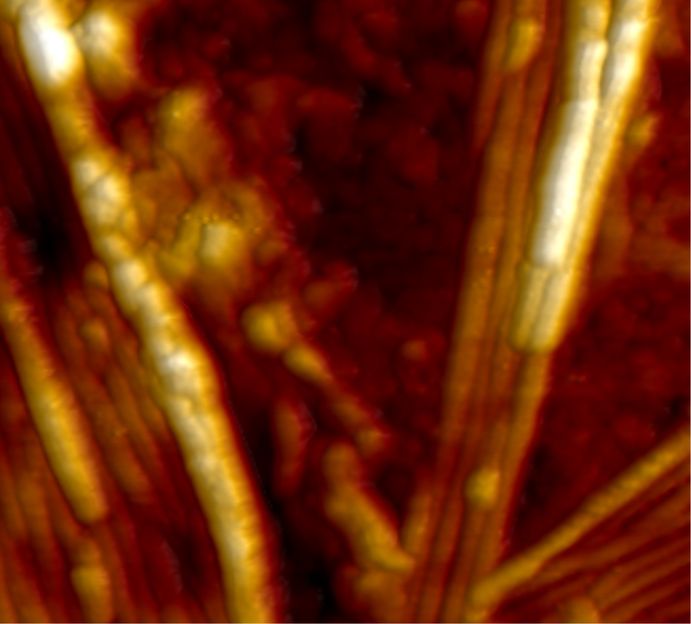
Une heure après le début de la réaction, on peut voir des fibrilles claires très actives sur lesquelles s'accumulent de nouveaux éléments protéiques.
Empa

Le traitement des démences telles que la maladie d'Alzheimer reste l'un des grands défis de la médecine moderne. Au cours de ces maladies neurodégénératives, des protéines comme la protéine amyloïde β s'accumulent dans le cerveau. Elles sont soupçonnées d'être liées au développement de la maladie, raison pour laquelle elles sont considérées comme une cible prometteuse pour de nouvelles approches thérapeutiques.
On sait déjà que les protéines mal repliées s'agglutinent en structures fibreuses. La manière dont ces fibrilles se forment n'est toutefois pas encore totalement élucidée. Une équipe dirigée par le chercheur de l'Empa Peter Nirmalraj du laboratoire « Transport at Nanoscale Interfaces » à Dübendorf, en collaboration avec des scientifiques de l'université irlandaise de Limerick, a pu montrer comment le processus se déroule grâce à une technique d'imagerie particulièrement performante. La particularité : certaines fibrilles d'une épaisseur de l'ordre du nanomètre assurent apparemment la propagation de la maladie dans le tissu cérébral et sont donc appelées « superspreaders ».
Sous-espèces toxiques
Cette sous-espèce particulière de fibrilles de protéines a attiré l'attention des chercheurs en raison de ses propriétés inhabituelles : Les bords et la surface des fibrilles dites superspreaders présentent une activité catalytique particulièrement élevée. De nouveaux composants protéiques se fixent à ces endroits hautement actifs. Par la suite, de nouvelles fibrilles à longue chaîne se forment à partir de ces sites de germination. Les chercheurs partent du principe que ces fibrilles de deuxième génération finissent par se propager et former de nouveaux agrégats dans le cerveau.
Certes, la composition chimique de la protéine amyloïde β mal repliée est connue. Cependant, le mécanisme par lequel les éléments protéiques s'assemblent pour former des fibrilles de deuxième génération, ainsi que leur forme et leur structure, n'étaient pas clairs jusqu'à présent. « Avec les méthodes traditionnelles, qui reposent par exemple sur des techniques de coloration, la forme et d'autres propriétés des protéines peuvent être modifiées, de sorte qu'elles ne peuvent pas être analysées dans leur forme naturelle », explique Peter Nirmalraj.
Une précision sans précédent
La technique utilisée par les chercheurs dans cette nouvelle étude se distingue sur ce point des méthodes traditionnelles : Les protéines sont ainsi analysées telles quelles dans une solution saline à température ambiante, ce qui est beaucoup plus proche des conditions physiologiques du corps humain. Le microscope à force atomique à haute résolution permet de photographier les fibrilles de moins de dix nanomètres d'épaisseur avec une précision inédite. Les chercheurs ont pu suivre le processus de formation des fibrilles en temps réel, depuis les premiers instants jusqu'aux 250 heures suivantes. Les analyses ont ensuite été comparées et complétées par des calculs de modélisation moléculaire. Les fibrilles ont ainsi pu être classées en sous-populations, comme par exemple les « superspreaders », en fonction de leurs structures de surface. « Nous faisons ainsi un pas de plus vers la compréhension de la manière dont ces protéines se propagent dans le cerveau en cas de démence », explique Peter Nirmalraj, chercheur à l'Empa. Il espère qu'il sera finalement possible d'en déduire de nouvelles procédures permettant de mieux détecter et surveiller les démences.