Les chercheurs "filment" l'activation d'un récepteur important
Une étude pourrait conduire à la mise au point de médicaments améliorés
Une équipe internationale de chercheurs a réussi à "filmer" l'activation d'un récepteur important. Ils ont gelé les molécules impliquées à différents moments et les ont photographiées au microscope électronique. Ils ont ensuite pu placer ces images fixes dans une séquence. Cette séquence montre étape par étape les changements spatiaux que subit le récepteur lorsqu'il est activé. Des chercheurs de la Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU) ont largement contribué à l'étude. Les résultats, qui viennent d'être publiés dans la revue Nature, pourraient conduire à moyen terme à la mise au point de médicaments plus efficaces.
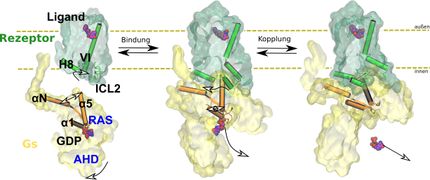
Les cellules communiquent entre elles par l'intermédiaire de molécules de signalisation qu'elles détectent à l'aide de structures réceptrices spécifiques appelées récepteurs. Ces structures sont intégrées dans la membrane cellulaire, la fine couche qui entoure la cellule. Un groupe particulièrement important de récepteurs est connu sous le nom de RCPG. Si une molécule de signal appropriée se fixe à l'extérieur du récepteur, une chaîne complexe de réactions se met en branle. Le récepteur modifie sa structure spatiale, activant ainsi une protéine G à l'intérieur de la cellule qui est attachée au récepteur. Cette protéine se déplace et peut alors, par exemple, faire la navette avec une enzyme de la cellule par diffusion pour réguler cette enzyme ou activer ou désactiver la transcription de certains gènes.
"L'homme possède plus de 800 RCPG, dont chacun est spécialisé dans la détection d'un signal particulier", explique le professeur Peter Gmeiner, titulaire de la chaire de chimie pharmaceutique à la FAU. Peter Gmeiner, titulaire de la chaire de chimie pharmaceutique à la FAU. "Dans notre étude, nous nous sommes concentrés sur un RCPG particulier, le récepteur b2-adrénergique. Il est activé par l'adrénaline et intervient, par exemple, dans la régulation des fonctions cardiaques et pulmonaires." Il s'agit donc également d'un point de départ important pour le développement de médicaments destinés à traiter l'asthme ou l'insuffisance cardiaque. "Pour ce faire, il est toutefois important de bien comprendre l'activation du récepteur et de la protéine G qui lui est liée", explique M. Gmeiner.
Les résultats qui viennent d'être publiés pourraient apporter une contribution significative. L'équipe internationale dirigée par Georgios Skiniotis (Université de Stanford) et comprenant Brian Kobilka (Université de Stanford), Peter Hildebrand (Universität Leipzig et Charité Berlin) et Peter Gmeiner a réussi à décomposer le processus d'activation du récepteur, étape par étape. Les chercheurs ont utilisé une méthode spéciale connue sous le nom de microscopie électronique cryogénique à résolution temporelle. Le complexe composé du récepteur et de la protéine G est congelé à -150 degrés peu de temps après son activation. "Sous le microscope, nous obtenons une série d'images différentes", explique Gmeiner. "Différentes, parce que les milliers de molécules que nous observons au microscope ne sont jamais entièrement synchrones. Leur mobilité naturelle fait que certaines sont figées à un stade d'activation un peu plus précoce et d'autres à un stade plus avancé".
Cette "congélation par choc" peut être répétée à différents moments après l'activation. Les images obtenues permettent aux chercheurs de reconstruire le processus étape par étape, au niveau atomique. "Dans notre travail, nous nous concentrons principalement sur les changements de la structure spatiale de la protéine G déclenchés après que le médicament se soit fixé au récepteur b2-adrénergique", explique M. Gmeiner. Son groupe a largement contribué à la réussite du projet : il a récemment réussi à créer une sorte de "super adrénaline" qui se lie particulièrement bien au récepteur b2.
"Cette liaison forte stabilise le complexe composé du récepteur et de la protéine G", explique le scientifique de la FAU. Normalement, cette tâche incombe à des protéines connues sous le nom de protéines adaptatrices. Elles agissent comme un chewing-gum moléculaire et maintiennent le complexe ensemble. "Cependant, elles font si bien leur travail qu'aucune étape intermédiaire n'est visible au microscope électronique cryogénique", explique Gmeiner. Grâce à sa "super adrénaline", les chercheurs ont pu se passer des protéines adaptatrices. Le complexe récepteur-protéine G est suffisamment stable sans elles. "Ce n'est qu'ensuite que nous avons pu rendre le mouvement visible".
Les résultats pourraient faciliter le développement de nouveaux médicaments, et pas seulement ceux qui ont un effet sur les récepteurs adrénergiques b2. Les RCPG sont considérés comme jouant un rôle central dans la lutte contre les maladies. Près d'un tiers des médicaments autorisés aujourd'hui influencent la fonction de ces récepteurs, par exemple en renforçant ou en affaiblissant la transmission des signaux aux cellules. La microscopie électronique cryogénique à résolution temporelle devrait faciliter la mise au point de médicaments particulièrement efficaces, adaptés à un besoin spécifique et présentant donc moins d'effets secondaires", espère M. Gmeiner.
Pour cela, il est essentiel que les chercheurs comprennent parfaitement les processus moléculaires des récepteurs et des protéines G qui les accompagnent. Le prix Nobel remporté il y a quelques années par Brian Kobilka, l'un des chercheurs impliqués dans le programme actuel, montre à quel point cela est important. Il a été le premier à déterminer la structure tridimensionnelle d'un RCPG par cristallographie aux rayons X, à l'échelle atomique et dans trois états différents. Un médicament sur mesure développé par le laboratoire de Peter Gmeiner a également été utilisé dans ces expériences.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.
Publication originale
Makaía M. Papasergi-Scott, Guillermo Pérez-Hernández, Hossein Batebi, Yang Gao, Gözde Eskici, Alpay B. Seven, Ouliana Panova, Daniel Hilger, Marina Casiraghi, Feng He, Luis Maul, Peter Gmeiner, Brian K. Kobilka, Peter W. Hildebrand, Georgios Skiniotis; "Time-resolved cryo-EM of G-protein activation by a GPCR"; Nature, 2024-3-13