Microbiome nasal unique
Une étude révèle des différences individuelles dans la réponse immunitaire du nez. Des chercheurs de l'Université de Tübingen donnent un nouvel aperçu de la réaction spécifique des anticorps de l'immunoglobuline A de l'organisme. Les résultats aident à mieux comprendre la réponse immunitaire de l'organisme.
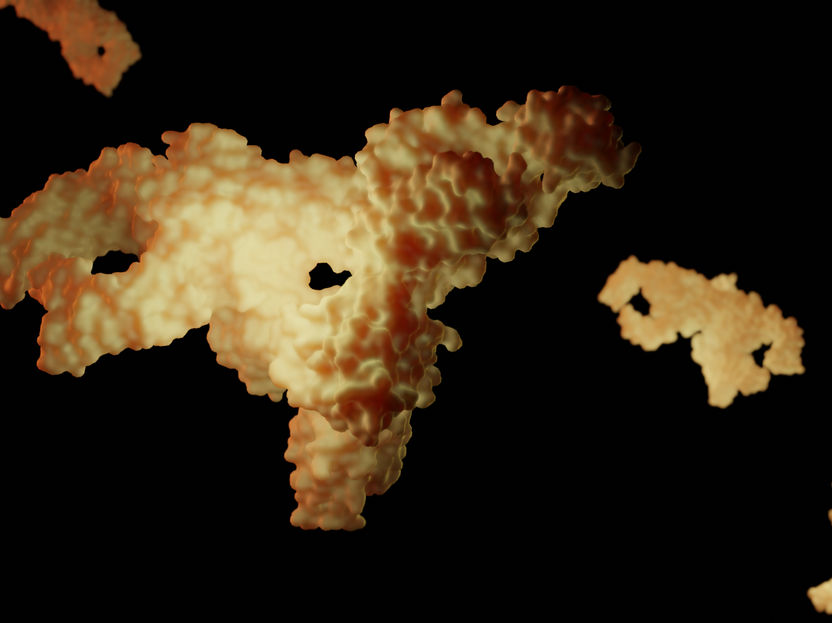
L'anticorps sécrétoire immunoglobuline A (sIgA), naturellement présent dans les fluides corporels du corps humain. L'étude a examiné sa réactivité avec les bactéries du microbiome nasal. Exemple de représentation de sIgA 6LX3 L'anticorps sécrétoire immunoglobuline A (sIgA), naturellement présent dans les fluides corporels du corps humain. L'étude a examiné sa réactivité avec les bactéries du microbiome nasal. Exemple de représentation de sIgA 6LX3
© Leon Kokkoliadis / Universität Tübingen.
Une étude récemment publiée dans la revue spécialisée Microbiome apporte un nouvel éclairage sur l'interaction complexe entre le système immunitaire humain et les micro-organismes qui colonisent notre nez. Les réactions immunitaires locales dans le nez sont très probablement un facteur décisif pour les infections par des agents pathogènes respiratoires. Pourtant, cette partie du système immunitaire est restée largement inexplorée jusqu'à présent. L'étude s'est concentrée sur l'anticorps de l'organisme, l'immunoglobuline A sécrétoire, ou sIgA. Cet anticorps est essentiel pour la réponse immunitaire de l'organisme, car il participe activement à la neutralisation des agents pathogènes. sIgA est présent en abondance dans nos sécrétions nasales, notre salive, notre sueur, notre liquide intestinal, nos larmes et le lait maternel.
De fortes différences individuelles dans la réponse immunitaire
L'étude a pu montrer que les quantités d'IgA de différentes personnes pouvaient varier de plus de cent fois. Pour de nombreuses bactéries, le score IgA, qui mesure la réactivité de l'anticorps vis-à-vis d'une espèce bactérienne donnée, était également très variable. Certaines personnes ont montré une réponse IgA claire vis-à-vis de certains micro-organismes, alors que d'autres ne l'ont pas fait. Cela suggère que la muqueuse nasale de chaque individu réagit différemment aux microbes qui l'entourent, ce qui pourrait éventuellement expliquer des différences de sensibilité aux infections.
Des chercheurs du cluster d'excellence "Controlling Microbes to Fight Infections" (CMFI) de l'université de Tübingen ont observé une réaction hautement individualisée de l'IgS aux microbes qui vivent dans le nez humain. L'intensité de la réponse immunitaire pourrait dépendre de la génétique de l'hôte, de son système immunitaire et des conditions locales. Cette découverte souligne la nature unique de la réponse immunitaire humaine.
Réguler le microbiome nasal pour lutter contre les infections
L'étude s'est concentrée sur l'observation de l'interaction entre sIgA et la bactérie Staphylococcus aureus. S. aureus est une bactérie qui se trouve naturellement dans le nez de nombreuses personnes et qui est initialement inoffensive. S. aureus peut toutefois se développer en une variante pathogène et provoquer des infections. La réaction de la variante résistante aux antibiotiques SARM, connue comme germe hospitalier et redoutée pour ses infections dangereuses et difficiles à traiter, a notamment été étudiée. Il est intéressant de noter que sIgA semble avoir une interaction spécifique avec une protéine appelée SpA, qui se trouve à la surface de S. aureus. Cela suggère de nouvelles approches thérapeutiques potentielles, dans lesquelles cette interaction pourrait éventuellement être manipulée afin de renforcer la réponse immunitaire ou de neutraliser plus efficacement la bactérie pathogène.
"Nous commençons à comprendre de mieux en mieux les processus qui se déroulent dans nos microbiomes. Les interactions de l'anticorps sIgA avec le microbiome nasal nous montrent de manière impressionnante comment ces systèmes microbiens se régulent - et pourraient être régulés. Nous avons là un énorme potentiel pour de futures méthodes de traitement", explique Rob van Dalen, post-doctorant au sein du cluster d'excellence CMFI et premier auteur de l'étude.
Des écouvillons nasaux d'environ 50 personnes en bonne santé ont été analysés. Il s'est avéré que la quantité de sIgA présente dans la muqueuse nasale a une influence directe sur le nombre de bactéries qui y vivent. Les personnes présentant des taux plus élevés de sIgA semblent être colonisées par moins de bactéries, ce qui suggère que cet anticorps joue un rôle dans la régulation de la population microbienne et empêche ainsi également la croissance de bactéries nocives. sIgA pourrait se prêter à de nouvelles méthodes de traitement.
Mais même si les résultats sont prometteurs, il faudra peut-être encore attendre longtemps avant que de nouvelles méthodes de traitement soient développées.
"Nous parlons souvent de 'Bench to Bedside', c'est-à-dire de la transposition en clinique des résultats de recherche obtenus sur le banc de laboratoire. Mais le chemin est souvent long jusqu'à ce que cette translation réussisse. Nous avons besoin des bons investisseurs et partenaires, qui sont prêts à emprunter cette voie avec nous", explique le responsable de l'étude, Andreas Peschel, professeur de microbiologie à l'université de Tübingen et porte-parole du cluster d'excellence CMFI.
Les résultats de la recherche qui viennent d'être présentés élargissent la compréhension de la manière dont le système immunitaire et le microbiome travaillent ensemble pour préserver la santé humaine.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Allemand peut être trouvé ici.