Plus que ce que les microscopes peuvent montrer
Des simulations par ordinateur permettent de visualiser comment une protéine essentielle des cellules souches ouvre l'ADN enroulé
Une protéine essentielle à la conversion des cellules souches adultes en cellules ressemblant à des cellules souches embryonnaires a été visualisée avec des détails sans précédent par une équipe internationale de chercheurs autour de Hans Schöler et Vlad Cojocaru de l'Institut Max Planck de biomédecine moléculaire de Münster. En combinant expériences et simulations informatiques, l'équipe a visualisé comment la protéine Oct4 se lie et ouvre de courts morceaux d'ADN tout en s'enroulant autour de protéines de stockage nucléaires (histones), comme dans notre génome.
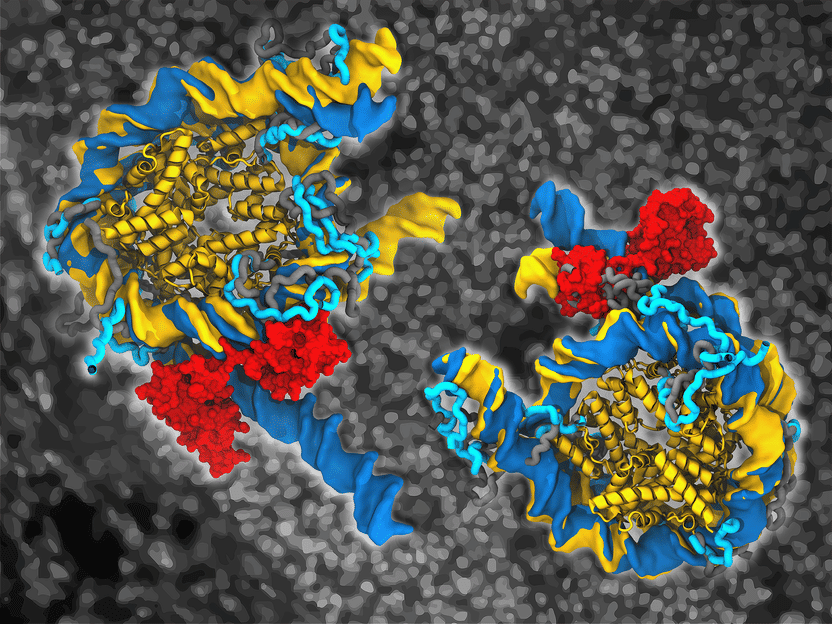
Nucléosomes génomiques natifs liés (bleu foncé) par Oct4 (rouge) et sous forme libre (jaune). Les surfaces et les rubans illustrent respectivement l'ADN et les régions structurées du noyau des histones.
Vlad Cojocaru
Les cellules adultes peuvent être converties en cellules semblables à des cellules souches embryonnaires (cellules pluripotentes induites, iPSC) à l'aide d'un cocktail de quatre protéines seulement. Ces dernières années, cette technologie de reprogrammation cellulaire a énormément contribué à la modélisation des maladies, au développement de médicaments et aux thérapies de remplacement cellulaire. Cependant, de nombreuses questions sur les mécanismes moléculaires de cette conversion restent sans réponse. Par exemple, une étape essentielle est l'ouverture de l'ADN dans les cellules à convertir. Chacune de nos cellules contient environ deux mètres d'ADN emballé dans une structure appelée chromatine. Dans la chromatine, l'ADN est étroitement enroulé autour des histones dans des unités structurelles répétitives appelées nucléosomes. Alors, comment ces quatre protéines ouvrent-elles l'ADN lorsqu'elles sont exprimées dans les cellules adultes ?
Oct4, un régulateur pionnier des cellules souches pluripotentes
Trois des quatre protéines ont été décrites comme des facteurs de transcription pionniers, ce qui signifie qu'elles se lient à des séquences spécifiques d'ADN alors qu'elles sont enveloppées dans des nucléosomes et qu'elles ont la capacité d'ouvrir directement ou indirectement la chromatine. Parmi les trois, Oct4 se distingue car elle est essentielle au maintien des cellules souches embryonnaires de différentes espèces et à la reprogrammation des cellules humaines. Oct4 a été découverte à la fin des années 80 par Hans Schöler, à peu près en même temps que deux autres laboratoires, et constitue le seul facteur irremplaçable du cocktail de Shinya Yamanaka, lauréat du prix Nobel, pour la reprogrammation de cellules adultes en cellules pluripotentes. Il y a une dizaine d'années, Abdenour Soufi et Ken Zaret ont décrit des régions d'ADN emballé qui sont liées par Oct4 dans les premiers stades de la reprogrammation.
Caitlin MacCarthy, post-doc dans le groupe de Hans Schöler et l'un des principaux auteurs de l'étude, a réalisé les expériences en laboratoire. Réfléchissant à son travail, MacCarthy explique : "Les expériences ont été plus difficiles que nous l'avions prévu. Travailler avec des nucléosomes génomiques ou natifs devient assez technique car ils sont très dynamiques, contrairement aux séquences modifiées qui sont plus stables. Néanmoins, nous avons pu montrer précisément où Oct4 se lie à eux". Que se passe-t-il donc lorsque Oct4 se lie aux nucléosomes ?
Un nanoscope computationnel
Pour répondre à cette question, Jan Huertas, également auteur principal de l'étude, a fourni les simulations qu'il a réalisées au cours de ses études de doctorat au MPI de Münster. Lui et Vlad Cojocaru ont utilisé le nanoscope computationnel pour visualiser comment Oct4 se lie aux nucléosomes et affecte leur structure. Le terme "nanoscope computationnel" est utilisé par les chercheurs pour désigner un ensemble de méthodes de simulation informatique qui leur permettent de visualiser les mouvements des molécules dans le temps. La précision de ces méthodes est désormais telle que l'on peut imaginer observer les molécules sous un microscope à très haute résolution. Les nucléosomes, comme toutes les structures macromoléculaires de nos cellules, sont dynamiques. Ils bougent, se tordent, respirent, se déballent et s'enroulent à nouveau. Visualiser ces mouvements dans les expériences est souvent impossible. Huertas explique : "C'est tellement incroyable de pouvoir regarder ces grandes structures moléculaires avec tous leurs atomes se déplacer sur l'ordinateur et de savoir que ce que l'on voit est très proche de ce qui se passe réellement."
Oct4 ouvre les nucléosomes
Dans les films en temps réel des complexes Oct4-nucléosomes qu'ils ont générés, chacun montrant 1 à 3 microsecondes de la vie du complexe, Huertas et Cojocaru ont observé comment Oct4 est capable d'ouvrir les nucléosomes. Ils ont décrit dans les moindres détails les mécanismes de cette ouverture en comparant les mouvements de nucléosomes libres et liés à Oct4. Il est intéressant de noter que l'ouverture dépend de la position de la séquence d'ADN reconnue par Oct4 sur le nucléosome et de la mobilité des régions terminales flexibles des histones, appelées queues d'histones.
Vers la compréhension des facteurs pionniers et des conversions du destin cellulaire
Les chercheurs sont enthousiasmés par les implications de leurs travaux et les perspectives d'avenir. Cojocaru, qui est aujourd'hui un chercheur de premier plan à l'université Babeş-Bolyai et qui occupe également le poste de chercheur principal à l'université d'Utrecht et de chercheur invité au MPI de Münster, conclut : "Nous montrons ici pour la première fois dans les détails atomiques non seulement comment Oct4 se lie à différents nucléosomes, mais aussi comment la liaison d'Oct4 avec les queues d'histones affecte la flexibilité structurelle de ces nucléosomes." MacCarthy ajoute en expliquant pourquoi cela est si excitant : "parce que les queues d'histones, comme les facteurs pionniers, sont également des régulateurs clés de l'expression génétique. Alors que les facteurs pionniers se lient à l'ADN pour ouvrir la chromatine et activer les gènes, les queues d'histones portent des modifications chimiques qui définissent les régions de chromatine ouverte à partir desquelles les gènes peuvent être exprimés." Huertas explique encore : "Jusqu'à présent, la manière dont les queues d'histones affectent la capacité des facteurs pionniers à se lier et à ouvrir les nucléosomes est restée un mystère. Nos travaux ouvrent la voie à de futures études sur d'autres facteurs pionniers, dont beaucoup sont essentiels aux transformations cellulaires, notamment aux conversions du destin cellulaire et au cancer." Cojocaru est convaincu que "le mécanisme que nous décrivons ici comble une lacune dans la compréhension de la manière dont des facteurs comme Oct4 induisent les transitions du destin cellulaire. La compréhension de ces mécanismes fournira éventuellement des moyens d'optimiser et de contrôler ces transitions pour une utilisation réussie dans les thérapies. Et les simulations informatiques seront au cœur de ces futures découvertes."
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.