Utiliser des nanopores pour détecter plus rapidement les modifications épigénétiques
Un pas vers l'optimisation des diagnostics médicaux
Les changements connus sous le nom de modifications épigénétiques jouent, entre autres, un rôle important dans le développement du cancer. Pouvoir les analyser rapidement et de manière fiable pourrait, par exemple, contribuer de manière significative au développement de la thérapie personnalisée. Une équipe de recherche de l'Institut de physiologie de l'Université de Fribourg a réussi à caractériser les changements chimiques dans les protéines qui sont typiques des modifications épigénétiques en utilisant l'analyse nanopore. Les chercheurs ont publié leurs résultats dans le Journal of the American Chemical Society (JACS).
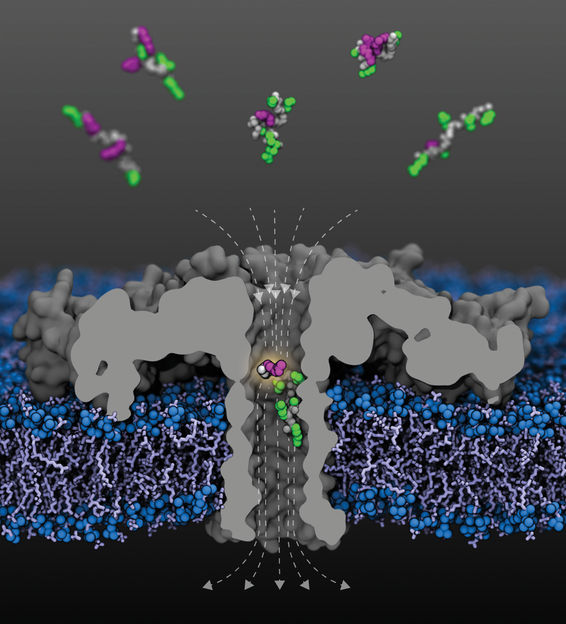
Vue en coupe du pore de l'aérolysine modifiée (R220S) (en gris) avec des lignes de champ (en pointillés) dans une membrane lipidique. Des fragments de la protéine histone humaine 4 acétylée à divers résidus lysine arrivent du compartiment supérieur ; un fragment acétylé à la lysine-8 est représenté à l'intérieur du pore. Les squelettes peptidiques sont représentés en gris, les chaînes latérales non modifiées en vert, et les lysines acétylées en violet.
Sarthak Kumar, University of Illinois at Urbana-Champaign
Ces dernières années, les nanopores sont devenus un outil largement applicable pour l'analyse des molécules. Grâce à leurs propriétés particulières, ils permettent d'analyser la structure des molécules en quelques fractions de seconde : sous forme de protéines disposées de façon cylindrique, les nanopores forment de minuscules canaux de quelques millionièmes de millimètre (nanomètre) de diamètre qui peuvent être intégrés dans des biomembranes. "Pour les expériences, nous appliquons une tension constante sur la membrane afin que les ions du milieu environnant traversent le pore. Cela crée un courant électrique constant, mesurable avec précision", explique le professeur Jan C. Behrends, de la faculté de médecine de l'université de Fribourg, dans le laboratoire duquel ont eu lieu les expériences publiées aujourd'hui. Cependant, lorsqu'une molécule migre dans le pore, le courant est bloqué : plus la molécule est grosse, plus le blocage est fort.
Une protéine sous les projecteurs de la recherche : H4
Dans le cadre des expériences publiées aujourd'hui, les scientifiques de Fribourg se sont consacrés à l'étude de la protéine d'histone H4. Cette protéine est fermement associée à l'ADN dans toutes les cellules dotées d'un noyau et constitue l'une des cibles les mieux étudiées des modifications épigénétiques. Une région située à l'extrémité N-terminale de la protéine est particulièrement affectée par ces modifications. "La séquence de la protéine contient plusieurs fois l'acide aminé lysine", explique Behrends. Des groupes acétyle ou méthyle, par exemple, peuvent être attachés à ces lysines, qui sont désignées K8, K12 et K16 selon leur position dans la chaîne protéique, dans le cadre de modifications épigénétiques. Comme le souligne le physiologiste fribourgeois, quelle modification chimique a lieu à quelle position de la lysine a une importance médicale certaine. "L'acétylation à K16, par exemple, est importante pour le développement humain, tandis que la méthylation à K12 joue un rôle dans le développement de certaines tumeurs de la prostate et du poumon, selon les derniers résultats du Medical Center - University of Freiburg."
Détecter les changements à l'aide d'un nanopore
Dans leurs expériences, Behrends et son équipe ont maintenant pu distinguer clairement les fragments H4 avec ou sans acétylation, ainsi que les fragments avec une, deux ou trois acétylations. De plus, ils ont réussi à démontrer que le nanopore utilisé était également sensible au site d'acétylation : les fragments d'histone avec un groupe acétyle en K8 bloquaient le courant à travers le pore plus fortement que ceux acétylés en K12, et ceux-ci à leur tour plus fortement que ceux avec une acétylation en K16. "Ce type de sensibilité est surprenant dans la mesure où ces fragments sont identiques en termes de masse et de volume total", explique Behrends. Ainsi, le courant de pore semble être sensible non seulement à la taille, mais aussi à la forme de la molécule. Il était tout aussi facile de distinguer les différentes variantes de fragments d'histone doublement acétylés - K8 et K12, K8 et K16, et K12 et K16 - là encore, malgré une masse identique. Les fragments H4 méthylés à différents degrés et à différentes positions ont également bloqué le courant à travers le pore à différents degrés, mais pas aussi clairement que les variantes acétylées.
"Nos expériences nous ont permis de montrer pour la première fois que l'analyse des nanopores nous permet de distinguer les molécules non seulement par leur taille, mais aussi par leur forme", résume le responsable de l'étude, M. Behrends. Les simulations de dynamique moléculaire réalisées par le groupe de recherche dirigé par Aleksei Aksimentiev de l'université de l'Illinois aux États-Unis - également impliqué dans l'étude - montrent qu'un champ électrique hautement inhomogène à l'intérieur du pore joue un rôle clé pour cet effet.
Vision future : des diagnostics médicaux optimisés
Si le séquençage de l'ADN à l'aide de nanopores est déjà établi et commercialisé, le développement de l'analyse des protéines par nanopores ne fait que commencer, souligne M. Behrends. "La difficulté du séquençage des protéines est qu'il s'agit de molécules dont les schémas de charge sont très peu uniformes." Alors que l'ADN, qui est chargé négativement, migre de manière directionnelle dans le champ électrique et peut donc être tiré à travers le pore base par base, les protéines sont constituées de blocs de construction composés d'acides aminés ayant des charges différentes. Par conséquent, il n'est pas possible d'effectuer un mouvement dirigé dans le champ électrique et de "scanner" acide aminé par acide aminé. Les scientifiques de Fribourg ont donc adopté une approche différente pour leurs expériences. Au lieu d'un pore avec une courte constriction, comme celui utilisé pour le séquençage de l'ADN, ils ont utilisé un pore sur mesure avec une sorte de piège moléculaire. "Cela a permis de capturer tout le fragment de protéine en une seule fois", explique Behrends.
On ne sait pas encore jusqu'à quelle taille de fragment ce type d'analyse peut être utilisé. Cependant, des expériences supplémentaires montrent que la méthode conviendra également à l'analyse des fragments H4 précédemment utilisés dans la recherche épigénétique. Ceux-ci contiennent 14 acides aminés au lieu des dix utilisés ici, et sont actuellement étudiés pour des modifications épigénétiques avec la spectrométrie de masse en tandem, une technique très élaborée. Les chercheurs espèrent que les nanopores rendront l'analyse beaucoup plus simple, plus rapide et plus rentable, et qu'elle pourra être effectuée à proximité du patient.
La poursuite du développement de l'analyse des protéines par nanopores pour le diagnostic médical et sa mise en œuvre dans des produits et services concrets est également l'un des projets centraux du cluster BMBF4Future nanodiagBW, récemment approuvé, que Behrends dirige avec le professeur Felix von Stetten de la Hahn-Schickard-Gesellschaft, qui est le chef de file de ce projet.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.