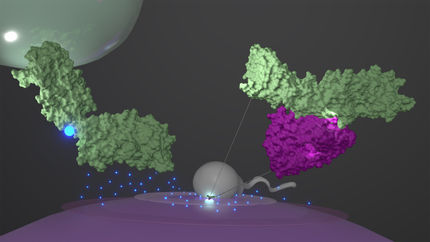
Comparaison de deux nanorègles
Une étude compare deux méthodes de mesure de la distance dans les protéines motiles
Au Moyen Âge, chaque ville avait son propre système de mesure. Aujourd'hui encore, on peut parfois trouver sur les marchés des tiges de fer qui déterminaient la mesure de longueur valable pour la ville à cette époque. En science, cependant, il n'y a pas de place pour de telles incertitudes, et quelle que soit la méthode utilisée pour mesurer la longueur d'une molécule, par exemple, la réponse devrait toujours être la même.
Des chercheurs de l'hôpital universitaire de Bonn (UKB), de l'université de Bonn et de la Ludwig-Maximilians-Universität (LMU) de Munich viennent d'examiner si cela est vrai pour deux méthodes très souvent utilisées pour mesurer les distances dans les molécules de protéines - par exemple, pour découvrir comment ces molécules se déplacent.
Les chercheurs du groupe du PD Dr Gregor Hagelueken à l'Institut de biologie structurelle de l'UKB ont utilisé la spectroscopie dite PELDOR pour étudier le mouvement des protéines dites de liaison au substrat. Ces protéines saisissent leur substrat et le transportent à un endroit précis de la cellule. Pour observer ce phénomène avec précision, les chercheurs ont fixé de minuscules aimants - qu'ils appellent "étiquettes de spin" - aux protéines et ont mesuré des distances de l'ordre du milliardième de mètre seulement. Ils ont ensuite transmis leurs résultats au groupe de recherche du professeur Thorben Cordes à la LMU de Munich. Là, des mesures comparatives ont été effectuées à l'aide de la spectroscopie FRET. De minuscules molécules de colorant ont été utilisées à la place des étiquettes de spin.
"Bien que les deux méthodes soient très fréquemment utilisées, personne n'a encore cherché systématiquement à savoir si les résultats étaient réellement comparables", explique M. Hagelueken. S'il s'est avéré que les résultats des mesures étaient comparables dans la plupart des cas, les chercheurs ont rencontré des incohérences dans deux cas. Martin Peter, chercheur post-doctoral à Bonn, explique : "Nous avons ensuite étudié en profondeur les causes de ces différences et avons trouvé ce que nous cherchions. Dans un cas, il s'est avéré que les molécules de colorant se sont collées à la protéine et ont donc faussé la mesure." Dans le second cas, l'ajout d'un type d'antigel, nécessaire en raison de la faible température de mesure, inférieure à -220 degrés Celsius, a entraîné des écarts inattendus. "Nous avons pu montrer que, malgré la grande précision des méthodes, il est toujours bon de remesurer avec une autre nano règle", déclare Hagelueken.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.
Publication originale
Actualités les plus lues
Publication originale
Martin F. Peter, Christian Gebhardt, Rebecca Mächtel, Gabriel G. Moya Muñoz Janin Glaenzer, Alessandra Narducci, Gavin H. Thomas, Thorben Cordes, Gregor Hagelueken: "Cross-validation of distance measurements in proteins by PELDOR/DEER and single-molecule FRET"; Nature Communications.
Sujets
Organisations
Autres actualités du département science

Recevez les dernières actualités du secteur des sciences de la vie
En soumettant ce formulaire, vous acceptez que LUMITOS AG vous envoie par e-mail la ou les newsletters sélectionnées ci-dessus. Vos données ne seront pas transmises à des tiers. Vos données seront stockées et traitées conformément à nos règles de protection des données. LUMITOS peut vous contacter par e-mail à des fins publicitaires ou d'études de marché et d'opinion. Vous pouvez à tout moment révoquer votre consentement sans indication de motifs à LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin, Allemagne ou par e-mail à revoke@lumitos.com avec effet pour l'avenir. De plus, chaque courriel contient un lien pour se désabonner de la newsletter correspondante.