L'imagerie par résonance magnétique montre pour la première fois une inflammation du cerveau in vivo
Chercheurs ont obtenu pour la première fois des images de l'activation de la microglie et des astrocytes
Les recherches des laboratoires dirigés par le Dr Silvia de Santis et le Dr Santiago Canals, tous deux de l'Institut des neurosciences UMH-CSIC (Alicante, Espagne), ont permis de visualiser pour la première fois et de manière très détaillée l'inflammation du cerveau à l'aide de l'Imagerie par résonance magnétique pondérée par diffusion. Cette "radiographie" détaillée de l'inflammation ne peut être obtenue avec l'IRM conventionnelle, mais nécessite des séquences d'acquisition de données et des modèles mathématiques spéciaux. Une fois la méthode mise au point, les chercheurs ont pu quantifier les altérations de la morphologie des différentes populations cellulaires impliquées dans le processus inflammatoire du cerveau.
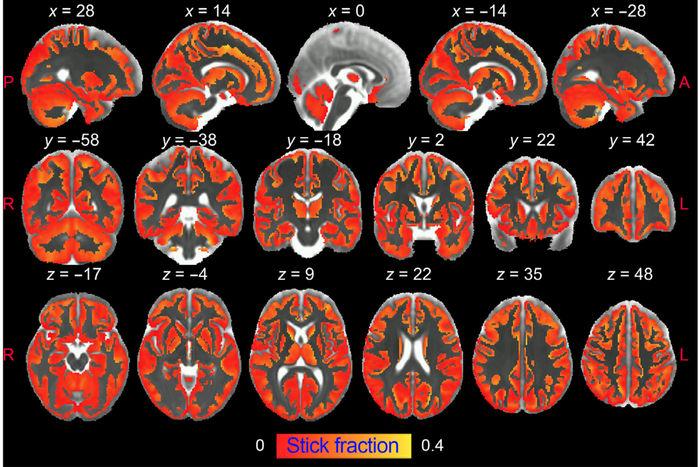
Des chercheurs de l'Institut des neurosciences UMH-CSIC ont mis au point une stratégie innovante qui permet d'imager l'activation des microglies et des astrocytes dans la matière grise du cerveau en utilisant l'imagerie par résonance magnétique pondérée par diffusion (dw-MRI).
IN-CSIC-UMH
Une stratégie innovante développée par les chercheurs a rendu possible cette importante avancée, publiée aujourd'hui dans la revue Science Advances et qui pourrait être cruciale pour changer le cours de l'étude et du traitement des maladies neurodégénératives.
La recherche, dont le premier auteur est Raquel Garcia-Hernández, démontre que l'IRM pondérée par diffusion peut détecter de manière non invasive et différentielle l'activation de la microglie et des astrocytes, deux types de cellules cérébrales qui sont à la base de la neuroinflammation et de sa progression.
Les maladies dégénératives du cerveau, telles que la maladie d'Alzheimer et d'autres démences, la maladie de Parkinson ou la sclérose en plaques, constituent un problème urgent et difficile à résoudre. L'activation soutenue de deux types de cellules cérébrales, la microglie et les astrocytes, entraîne une inflammation chronique du cerveau qui est l'une des causes de la neurodégénérescence et contribue à sa progression.
Cependant, on manque d'approches non invasives capables de caractériser spécifiquement l'inflammation cérébrale in vivo. L'étalon-or actuel est la tomographie par émission de positons (TEP), mais elle est difficile à généraliser et est associée à une exposition aux rayonnements ionisants, de sorte que son utilisation est limitée aux populations vulnérables et aux études longitudinales, qui nécessitent l'utilisation de la TEP de manière répétée sur plusieurs années, comme c'est le cas dans les maladies neurodégénératives.
Un autre inconvénient de la TEP est sa faible résolution spatiale, qui la rend inadaptée à l'imagerie des petites structures, avec l'inconvénient supplémentaire que les radiotraceurs spécifiques de l'inflammation sont exprimés dans plusieurs types de cellules (microglie, astrocytes et endothélium), ce qui rend impossible leur différenciation.
Face à ces inconvénients, l'IRM pondérée par diffusion a la capacité unique d'imager la microstructure du cerveau in vivo de manière non invasive et avec une haute résolution en capturant le mouvement aléatoire des molécules d'eau dans le parenchyme cérébral pour générer un contraste dans les images IRM.
Stratégie innovante
Dans cette étude, les chercheurs de l'Institut des neurosciences de l'UMH-CSIC ont mis au point une stratégie innovante qui permet d'imager l'activation des microglies et des astrocytes dans la matière grise du cerveau en utilisant l'imagerie par résonance magnétique pondérée par diffusion (dw-MRI).
"C'est la première fois qu'il est démontré que le signal de ce type d'IRM (dw-MRI) peut détecter l'activation microgliale et astrocytaire, avec des empreintes spécifiques pour chaque population cellulaire. La stratégie que nous avons utilisée reflète les changements morphologiques validés post-mortem par immunohistochimie quantitative", notent les chercheurs.
Ils ont également montré que cette technique est sensible et spécifique pour détecter une inflammation avec et sans neurodégénérescence, de sorte que les deux conditions peuvent être différenciées. De plus, elle permet de discriminer l'inflammation de la démyélinisation caractéristique de la sclérose en plaques.
Ce travail a également permis de démontrer la valeur translationnelle de l'approche utilisée dans une cohorte d'humains sains à haute résolution, "dans laquelle nous avons effectué une analyse de reproductibilité. L'association significative avec les schémas connus de densité de la microglie dans le cerveau humain soutient l'utilité de la méthode pour générer des biomarqueurs fiables de la glie. Nous pensons que la caractérisation, à l'aide de cette technique, des aspects pertinents de la microstructure des tissus pendant l'inflammation, de manière non invasive et longitudinale, peut avoir un impact considérable sur notre compréhension de la physiopathologie de nombreuses affections cérébrales, et peut transformer la pratique diagnostique actuelle et les stratégies de suivi du traitement des maladies neurodégénératives", souligne Silvia de Santis.
Pour valider le modèle, les chercheurs ont utilisé un paradigme établi d'inflammation chez les rats, basé sur l'administration intracérébrale de lipopolysaccharide (LPS). Dans ce paradigme, la viabilité et la morphologie des neurones sont préservées, tout en induisant, dans un premier temps, une activation de la microglie (les cellules du système immunitaire du cerveau), puis, de manière différée, une réponse des astrocytes. Cette séquence temporelle d'événements cellulaires permet de dissocier transitoirement les réponses gliales de la dégénérescence neuronale et d'étudier la signature de la microglie réactive indépendamment de l'astrogliose.
Pour isoler l'empreinte de l'activation astrocytaire, les chercheurs ont répété l'expérience en prétraitant les animaux avec un inhibiteur qui supprime temporairement environ 90 % de la microglie. Puis, à l'aide d'un paradigme établi de lésions neuronales, ils ont vérifié si le modèle était capable de révéler les "empreintes" neuroinflammatoires avec et sans neurodégénérescence concomitante. "Ceci est essentiel pour démontrer l'utilité de notre approche en tant que plateforme pour la découverte de biomarqueurs du statut inflammatoire dans les maladies neurodégénératives, où l'activation de la glie et les dommages neuronaux sont des acteurs clés", précisent-ils.
Enfin, les chercheurs ont utilisé un paradigme établi de démyélinisation, basé sur l'administration focale de lysolécithine, pour démontrer que les biomarqueurs développés ne reflètent pas les altérations tissulaires fréquemment rencontrées dans les troubles cérébraux.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.






















































