La recherche décrit le principe fondamental de la catalyse enzymatique
Comment les charges égales dans les enzymes contrôlent les réactions biochimiques.
Il est bien connu en physique et en chimie que des charges égales se repoussent, tandis que des charges opposées s'attirent. On a longtemps supposé que ce principe s'appliquait également lorsque les enzymes - les catalyseurs biologiques de tous les organismes vivants - forment ou rompent des liaisons chimiques. On pensait que les enzymes plaçaient des charges dans leurs "centres actifs", où les réactions chimiques ont effectivement lieu, de telle sorte qu'elles repoussent les charges similaires des autres molécules qui les entourent. Ce concept est connu sous le nom de "contrainte électrostatique". Par exemple, si le substrat (la substance sur laquelle l'enzyme agit) porte une charge négative, l'enzyme pourrait utiliser une charge négative pour "stresser" le substrat et ainsi faciliter la réaction. Cependant, une nouvelle étude menée par l'Université de Göttingen et l'Institut Max Planck pour les sciences multidisciplinaires de Göttingen vient de montrer que, contrairement aux attentes, deux charges égales n'entraînent pas nécessairement une répulsion, mais peuvent provoquer une attraction dans les enzymes. Les résultats ont été publiés dans la revue Nature Catalysis.
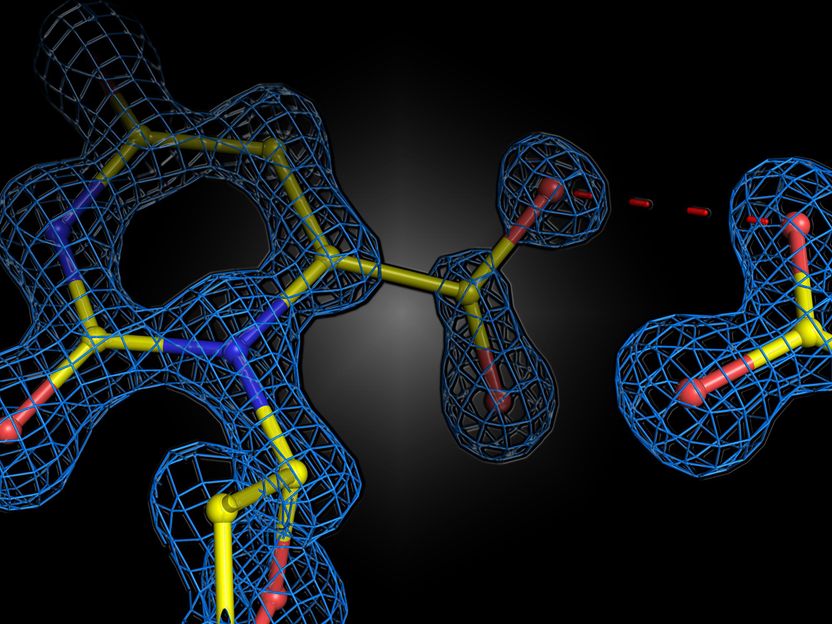
Instantané structurel de la réaction enzymatique de l'enzyme humaine orotidine 5'-phosphate décarboxylase. Les deux charges négatives du substrat et de l'enzyme ne se repoussent pas, mais forment une interaction attractive.
Kai Tittmann
L'équipe s'est penchée sur une enzyme bien connue qui a été étudiée en profondeur et qui constitue un exemple classique de catalyse enzymatique. Sans l'enzyme, la réaction est extrêmement lente : en fait, il faudrait 78 millions d'années pour que la moitié du substrat réagisse. L'enzyme accélère cette réaction par1017 fois, simplement en positionnant des charges négatives et positives dans le centre actif. Comme le substrat contient un groupe chargé négativement qui se sépare sous forme de dioxyde de carbone, on a supposé pendant des décennies que les charges négatives de l'enzyme servaient à stresser le substrat, qui est également chargé négativement, et à accélérer la réaction. Cependant, ce mécanisme hypothétique restait non prouvé car la structure de la réaction était trop rapide pour être observée.
Le groupe du professeur Kai Tittmann du Centre de biosciences moléculaires de Göttingen (GZMB) a maintenant réussi pour la première fois à utiliser la cristallographie des protéines pour obtenir un instantané structurel du substrat peu avant la réaction chimique. De manière inattendue, les charges négatives de l'enzyme et du substrat ne se repoussaient pas l'une l'autre. Au contraire, elles ont partagé un proton, qui a agi comme une sorte de colle moléculaire dans une interaction attractive. "La question de savoir si deux charges égales sont amies ou ennemies dans le contexte de la catalyse enzymatique a longtemps été controversée dans notre domaine, et notre étude montre que les principes de base du fonctionnement des enzymes sont encore loin d'être compris", déclare Tittmann. Les structures cristallographiques ont été analysées par le professeur Ricardo Mata, chimiste quantique, et son équipe de l'Institut de chimie physique de l'université de Göttingen. "Le proton supplémentaire, qui a une charge positive, entre les deux charges négatives n'est pas seulement utilisé pour attirer la molécule impliquée dans la réaction, mais il déclenche une cascade de réactions de transfert de protons qui accélèrent encore la réaction", explique Mata.
"Nous pensons que ces principes nouvellement décrits de la catalyse enzymatique aideront au développement de nouveaux catalyseurs chimiques", déclare Tittmann. "Comme l'enzyme que nous avons étudiée libère du dioxyde de carbone, le plus important gaz à effet de serre produit par les activités humaines, nos résultats pourraient aider à développer de nouvelles stratégies chimiques pour la fixation du dioxyde de carbone."
L'étude a impliqué des scientifiques du Centre de biosciences moléculaires de Göttingen (GZMB), de la Faculté de biologie et de psychologie et de la Faculté de chimie de l'Université de Göttingen, ainsi que de l'Institut Max Planck pour les sciences multidisciplinaires, du Laboratoire européen de biologie moléculaire (EMBL) de Hambourg et de l'Université de Toronto. Cette publication est dédiée à la mémoire du professeur Ulf Diederichsen, co-auteur, décédé l'année dernière.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.