Un estudio desvela la estructura tridimensional de un compuesto inhibidor de proteinasas
Un estudio internacional liderado por el Consejo Superior de Investigaciones Científicas (CSIC) ha desvelado, mediante cristalografía de rayos X, la estructura tridimensional de la partícula alfa2-macroglobulina. Esta proteína es un complejo inhibidor gigante que se encuentra en la sangre y es capaz de bloquear la acción de proteinasas (enzimas encargadas de cortar otras proteínas) de varios tipos. El descubrimiento del detalle de su estructura aporta datos que podrían ayudar en la investigación de enfermedades como el Alzheimer, el cáncer o el sida. El estudio ha sido publicado en Angewandte Chemie.
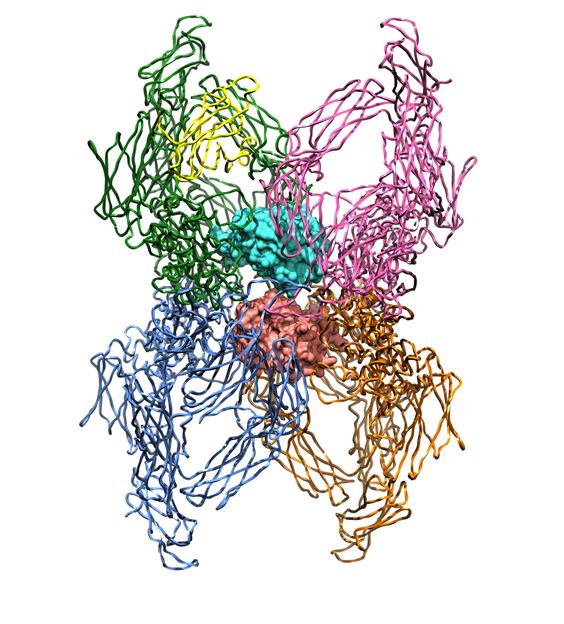
Ilustración de la estructura tetramérica de la alfa2-macroglobulina. Muestra dos moleculas de la proteasa del virus del SIDA atrapadas en su interior (en salmón y azul claro). Cada uno de los monómeros del inhibidor se muestra en un color diferente.
CSIC
“Lo novedosos de este inhibidor, que forma una gran cavidad central, es que atrapa sus presas en su interior mediante un sofisticado mecanismo, que recuerda al de las plantas carnívoras: un corte en una región anzuelo desencadena toda una serie de cambios a gran escala que hacen que la trampa se cierre y la proteinasa quede atrapada”, explica el investigador del CSIC Francesc Xavier Gomis, del Instituto de Biología Molecular de Barcelona.
Una vez cerrada, los cambios estructurales en la partícula inhibidora hacen que sea reconocida por receptores extracelulares de varios tipos de células. Este hecho hace que se internalice y sea degradada por los lisosomas de la célula. “El fallo en la regulación de las proteinasas puede dar lugar a procesos patológicos. El cáncer y la metástasis, el Alzheimer, las enfermedades cardiovasculares e inflamatorias, los procesos infecciosos por microorganismos, como la peste, el SIDA, el cólera, la malaria o la enfermedad de Chagas son algunos de los ejemplos de enfermedades que contemplan o se deben a la actuación nociva, errónea o descontrolada de proteinasas”, añade Gomis.
Los investigadores de este estudio han llegado a sus resultados mediante la técnica experimental de la cristalografía de proteínas. Este método requiere la purificación y aislamiento de una proteína mediante técnicas cromatográficas. Una vez se ha obtenido la proteína pura, se cristaliza y los microcristales resultantes se analizan con radiación de rayos X, que permiten resolver la estructura tridimensional.
“Una proteinasa es un enzima que corta otras proteínas, como las que tenemos en el tracto digestivo y que descomponen las proteínas que nos comemos. Otras participan en la complicada cascada de coagulación de la sangre y la fibrinólisis. Otras en emplean en remodelación de tejidos, como ocurre en procesos postmestruales, desarrollo embrionario, etc. Prácticamente no hay proceso biológico en el que no intervenga al menos una proteinasa. Como estas enzimas cortan otras proteínas, es muy importante que estén regulados de forma muy estricta y ahí es donde juegan un papel importantísimo los inhibidores”, concluye el investigador del CSIC.
Publicación original
Noticias más leídas
Publicación original
Aniebrys Marrero, Stephane Duquerroy, Stefano Trapani, Theodoros Goulas, Tibisay Guevara, Gregers R. Andersen, Jorge Navaza, Lars Sottrup-Jensen y F. Xavier Gomis-Rüth; "The crystal structure of human alpha2-macroglobulin reveals a unique molecular cage." Angewandte Chemie.
Temas
Organizaciones
Más noticias del departamento ciencias

Reciba la industria de las ciencias biológicas en su bandeja de entrada
Al enviar el formulario, se muestra usted de acuerdo con que LUMITOS AG le envíe por correo electrónico el boletín o boletines seleccionados anteriormente. Sus datos no se facilitarán a terceros. El almacenamiento y el procesamiento de sus datos se realiza sobre la base de nuestra política de protección de datos. LUMITOS puede ponerse en contacto con usted por correo electrónico a efectos publicitarios o de investigación de mercado y opinión. Puede revocar en todo momento su consentimiento sin efecto retroactivo y sin necesidad de indicar los motivos informando por correo postal a LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlín (Alemania) o por correo electrónico a revoke@lumitos.com. Además, en cada correo electrónico se incluye un enlace para anular la suscripción al boletín informativo correspondiente.
Noticias más leídas
Más noticias de nuestros otros portales
Contenido visto recientemente
Cómo una infección de corona cambia las células sanguíneas a largo plazo - El método podría servir de sistema de alerta temprana para detectar futuras pandemias por virus desconocidos

Analytica 2024: guía para el Laboratorio 4.0 - Mayor eficiencia mediante robots de laboratorio e inteligencia artificial
El camino equivocado: cómo los papilomavirus engañan al sistema inmunológico - Los anticuerpos específicos nos protegen contra las infecciones virales, ¿o no?




















































