Perfeccionamiento de las tijeras CRISPR
Un equipo de investigadores descubre un nuevo mecanismo proteínico anti-CRISPR para controlar con precisión las tecnologías de edición genómica
Las tijeras genéticas CRISPR-Cas ofrecen una amplia gama de aplicaciones potenciales, desde el tratamiento de enfermedades genéticas hasta terapias antivirales y diagnósticos. Sin embargo, para aprovechar con seguridad sus poderes, los científicos buscan mecanismos que puedan regular o inhibir la actividad de los sistemas. La proteína anti-CRISPR AcrVIB1 es un prometedor inhibidor cuya función exacta ha sido un misterio hasta ahora. Un equipo de investigadores del Instituto Helmholtz para la Investigación de Infecciones Basadas en el ARN (HIRI) de Würzburg, en colaboración con el Centro Helmholtz para la Investigación de Infecciones (HZI) de Braunschweig, ha descubierto la forma precisa en que funciona AcrVIB1, que amplía los medios conocidos por los que Acrs puede desactivar CRISPR. Los resultados se han publicado en la revista Molecular Cell.
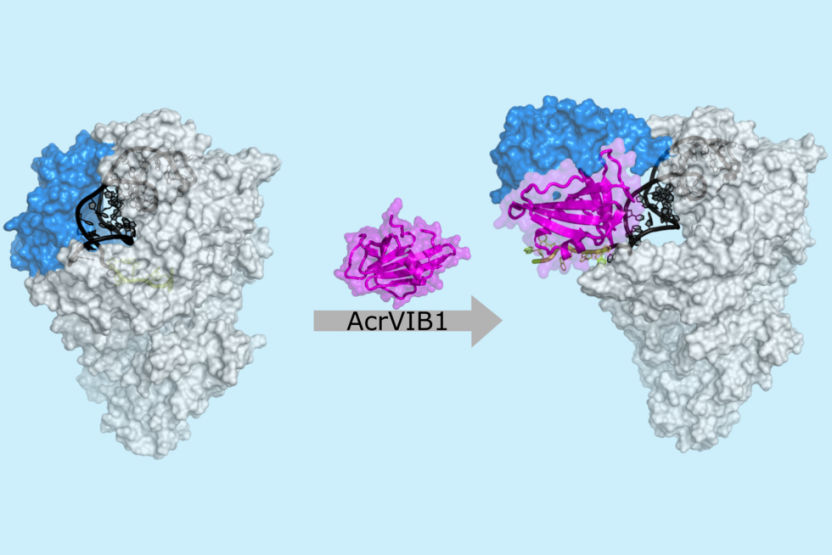
Imagen de criomicroscopía electrónica: La proteína anti-CRISPR AcrVIB1 (magenta) se une a la nucleasa Cas13b (gris claro) y refuerza su unión al ARN CRISPR (ARNcr; gris oscuro y verde). AcrVIB1 induce una reorganización estructural en la nucleasa (azul) y expone el ARN CRISPR, que puede ser escindido y posteriormente degradado.
© HZI / Stefan Schmelz
Las bacterias y sus virus, conocidos como fagos, están enzarzados en una antigua carrera armamentística. Para defenderse de los ataques de los fagos, las bacterias han desarrollado sofisticados mecanismos para reconocer y contrarrestar a los virus invasores. A su vez, los fagos han desarrollado estrategias innovadoras para eludir estas defensas. Un excelente ejemplo de esta batalla en curso es el sistema de defensa CRISPR-Cas de las bacterias, contrarrestado por las proteínas anti-CRISPR (Acrs) de los fagos, que bloquean específicamente estas "tijeras genéticas" bacterianas.
Aparte de su función contradefensiva, las proteínas anti-CRISPR son muy prometedoras para permitir un control más preciso de las tecnologías CRISPR. Para liberar todo su potencial, es esencial comprender los mecanismos subyacentes. Los investigadores del Instituto Helmholtz para la Investigación de Infecciones Basadas en el ARN (HIRI), una sede del Centro Helmholtz de Braunschweig para la Investigación de Infecciones (HZI) en cooperación con la Universidad Julius-Maximilians de Würzburg (JMU), y los científicos del HZI han dilucidado ahora la función de una importante proteína anti-CRISPR aún no caracterizada.
"En un estudio anterior, utilizamos un algoritmo de aprendizaje profundo para predecir nuevos Acrs. Esto condujo a la identificación de AcrVIB1, la primera proteína anti-CRISPR dirigida a la nucleasa Cas13b", dice el jefe del departamento de HIRI, el Prof. Chase Beisel, quien dirigió el estudio junto con el departamento del Prof. Wulf Blankenfeldt en HZI. "La nucleasa Cas13b puede reconocer y cortar ARN. Actualmente se utiliza para silenciar genes, ya sea para estudiar su función, eliminar virus o contrarrestar enfermedades genéticas relacionadas con el gen." Sin embargo, hasta ahora se desconocía cómo la proteína AcrVIB1 inhibe la Cas13b. En un estudio publicado hoy en la revista Molecular Cell, el equipo de investigadores presenta este mecanismo de bloqueo totalmente nuevo.
Un callejón sin salida de ARN
La nucleasa Cas13b funciona interactuando con un ácido ribonucleico CRISPR (ARNcr), que sirve de guía para identificar y unirse a secuencias de ARN complementarias, por ejemplo las procedentes de fagos. Una vez unido al ARN diana, Cas13b puede escindir y degradar no sólo estas moléculas de ARN complementario, sino también todos los demás ARN cercanos. Mientras que la mayoría de las proteínas anti-CRISPR conocidas bloquean etapas de este proceso, como la unión del ARNcr o el reconocimiento de la diana, AcrVIB1 adopta una estrategia radicalmente distinta: En lugar de bloquear la unión del ARNcr a Cas13b, AcrVIB1 incluso la mejora. Sin embargo, el par formado es disfuncional, lo que significa que la enzima no puede empezar a degradar ARN aunque su diana esté presente. Además, el ARNcr unido se vuelve vulnerable al ataque de las ribonucleasas celulares, que descomponen las moléculas de ARN.
"La unión más estrecha entre la nucleasa y el ARN guía fue totalmente inesperada. El mecanismo más sencillo y, por tanto, esperado inicialmente, habría sido impedir que el ARN guía se uniera", explica la Dra. Katharina Wandera, primera autora y doctoranda en el laboratorio de Chase Beisel. "Sin embargo, el camino tomado por AcrVIB1 parece ser más eficaz: AcrVIB1 se une fuertemente a Cas13b y, por tanto, lo vuelve inactivo. Al mismo tiempo, aumenta el recambio de los ARN guía, convirtiendo a Cas13b en un callejón sin salida para los ARNcr".
El equipo de Chase Beisel en el HIRI y el laboratorio de Wulf Blankenfeldt en el HZI han unido sus fuerzas para descifrar con mayor precisión la estructura del mecanismo de inhibición. Mediante criomicroscopía electrónica, el grupo de Blankenfeldt demostró que AcrVIB1 se une a Cas13b, dejando libre el dominio de unión al ARNcr. "Nuestro hallazgo proporciona un modelo para el desarrollo de moléculas que podrían imitar o modificar la función de la proteína anti-CRISPR", afirma Blankenfeldt. Estos son los primeros datos publicados de la nueva instalación de criomicroscopía electrónica del HZI.
Un vasto campo
"En el futuro, podríamos utilizar moléculas como AcrVIB1 para regular o desactivar temporalmente los sistemas CRISPR en una gran variedad de aplicaciones", afirma Blankenfeldt. Este descubrimiento podría mejorar aún más la seguridad y precisión de las tecnologías basadas en CRISPR.
"Descifrar este mecanismo también aporta información valiosa sobre la coevolución de bacterias y virus, que intentan constantemente ser más astutos que los demás", explica Wandera. El conocimiento más profundo de la resistencia bacteriana podría desempeñar un papel fundamental en el desarrollo de nuevos antibióticos y ampliar las posibilidades de la biología sintética.
En resumen, este estudio no sólo contribuye a una mejor comprensión de las estrategias anti-CRISPR, sino que también allana el camino para terapias y enfoques diagnósticos innovadores en medicina. "Pero esto es sólo el principio: Sin duda hay muchos más Acrs y mecanismos inhibidores novedosos esperando a ser descubiertos", afirma Beisel, ofreciendo una perspectiva sobre futuros proyectos de investigación.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.