Aprovechar la transferencia intercelular de mitocondrias para potenciar las inmunoterapias contra el cáncer
Una nueva plataforma contra el cáncer
Un equipo internacional de investigadores, dirigido por el profesor Luca Gattinoni en el Instituto Leibniz de Inmunoterapia (LIT), ha desarrollado una innovadora plataforma de transferencia mitocondrial para sobrecargar las células T CD8+, lo que les permite superar el agotamiento y combatir más eficazmente las células tumorales.
Las inmunoterapias contra el cáncer, que aprovechan el sistema inmunitario del paciente para atacar las células cancerosas, están revolucionando la forma de tratar a los pacientes. Las células inmunitarias pueden localizar y atacar tumores de diversas formas y adaptarse a su entorno. Sin embargo, como "fármacos vivos" que son, las células inmunitarias pueden quedarse sin combustible y agotarse, perdiendo su capacidad para combatir el cáncer. Las mitocondrias, principales fuentes de energía de la célula, son cruciales para mantener la función de las células inmunitarias, y su pérdida o disfunción está estrechamente relacionada con el agotamiento de las células inmunitarias. Las nuevas investigaciones han demostrado que las mitocondrias no son fijas, sino que pueden desplazarse de una célula a otra para restaurar su energía, alterar su comportamiento y prolongar su vida útil.
La transferencia mitocondrial como nueva plataforma contra el cáncer
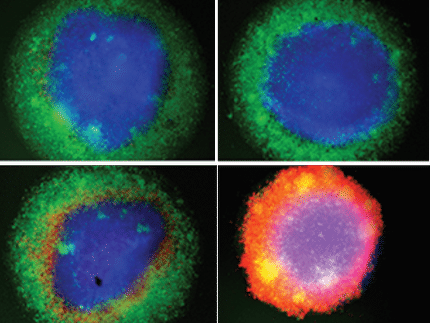
En un nuevo estudio publicado en Cell, el equipo del profesor Gattinoni descubrió que la transferencia mitocondrial se produce entre las células estromales de la médula ósea (BMSC) y las células T, el brazo funcional del sistema inmunitario responsable de eliminar las células cancerosas e infectadas. Las imágenes de alta resolución mostraron que las mitocondrias viajan a través de unos túneles diminutos llamados nanotubos, formando un puente entre las células. Las células T que recibieron mitocondrias del donante se sobrecargaron, se expandieron con más fuerza, se infiltraron en el tumor con más eficacia y mostraron menos signos de agotamiento en comparación con las células T que no recibieron mitocondrias.
"La transferencia mitocondrial como plataforma tecnológica es única porque, en lugar de dirigirnos a un único gen o vía específicos para mejorar las mitocondrias dentro de las células, transferimos orgánulos mitocondriales enteros e intactos. Este proceso es similar al trasplante de órganos -como corazón, hígado o riñón-, pero se produce a nivel microscópico, con la transferencia de orgánulos entre células para mejorar su función", explica el Dr. Jeremy Baldwin, investigador principal del trabajo. "Fue emocionante ver que este enfoque único podía abordar muchos de los retos actuales que limitan la eficacia de las terapias con células T, como la escasa expansión de las células T, la persistencia insuficiente, la infiltración tumoral inadecuada y la falta de función antitumoral sostenida", añade el Prof. Luca Gattinoni.
El equipo aplicó con éxito su técnica de transferencia mitocondrial a una amplia gama de plataformas de terapia con células T, incluidas células T modificadas con CAR y TCR, así como linfocitos infiltrados en tumores (TIL). "Anteriormente observamos que las células cancerosas pueden eludir los ataques de las células inmunitarias secuestrando las mitocondrias de las células inmunitarias. Ahora demostramos que podemos contrarrestarlo aprovechando la transferencia mitocondrial con fines terapéuticos", comenta el profesor Shiladitya Sengupta, de la Universidad de Harvard y coautor del artículo.
Un largo viaje da frutos de investigación
El Prof. Luca Gattinoni comenzó este viaje de investigación durante su estancia en el Instituto Nacional del Cáncer (NCI) tras recibir un premio Flex del NCI en 2016 para explorar el fenómeno de la transferencia de mitocondrias a células inmunitarias y siguió impulsando este audaz proyecto cuando trasladó su laboratorio al LIT de Alemania con el generoso apoyo del Programa de Integración de Clínicas y Laboratorios (CLIP) del Instituto de Investigación del Cáncer (CRI). "No puedo expresar con palabras la gratificante sensación de ver cómo evoluciona tu investigación a lo largo de los años, desde el descubrimiento inicial bajo el microscopio que aporta pruebas de transferencia hasta ver su desarrollo en aplicaciones del mundo real", comenta el Prof. Luca Gattinoni. Sin embargo, la investigación no se lleva a cabo de forma aislada, y en el proyecto han participado numerosos colaboradores de institutos punteros de todo el mundo (como los Institutos Nacionales de la Salud (NIH), la Universidad de Harvard, la Universidad San Raffaele, la ETH Zürich y la FAU Erlangen-Nürnberg), todos ellos aprovechando sus habilidades y competencias básicas únicas para alcanzar los objetivos de la investigación.
¿Cuáles son los próximos pasos?
El trabajo futuro se centrará en ampliar la tecnología a dosis celulares clínicamente relevantes. El equipo ya ha empezado a identificar los factores clave que regulan la transferencia mitocondrial, como Talin 2, una molécula implicada en la formación de los diminutos puentes que conectan las células. Además, se buscará un marcador sustitutivo para el enriquecimiento celular sin etiquetas y se identificarán subconjuntos de BMSC, los "superdonantes", que son los principales responsables de la transferencia mitocondrial. "Este descubrimiento está cambiando rápidamente nuestra comprensión fundamental de los sistemas biológicos. Estoy impaciente por ver hacia dónde avanza este campo y cómo podemos utilizar estos procesos en beneficio de los pacientes", concluye el Prof. Philipp Beckhove, director científico del LIT y colaborador en el estudio.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
Jeremy G. Baldwin, Christoph Heuser-Loy, Tanmoy Saha, Roland C. Schelker, Dragana Slavkovic-Lukic, Nicholas Strieder, Inmaculada Hernandez-Lopez,... Jacob E. Corn, Matteo Iannacone, Donato Inverso, Michael Rehli, Jessica Fioravanti, Shiladitya Sengupta, Luca Gattinoni; "Intercellular nanotube-mediated mitochondrial transfer enhances T cell metabolic fitness and antitumor efficacy"; Cell