Un modelo celular para el desarrollo de fármacos contra el hígado graso
Un modelo 3D de cultivo celular in vitro como base para el desarrollo de nuevas estrategias de tratamiento de una de las enfermedades más comunes en las naciones industrializadas
Científicos de la Facultad de Medicina de Mannheim, en la Universidad de Heidelberg, han desarrollado un sistema modelo que puede utilizarse para probar la eficacia de fármacos contra la enfermedad del hígado graso. Se trata de un sistema tridimensional (3D) de cultivo celular in vitro basado en células primarias del parénquima hepático humano (hepatocitos).
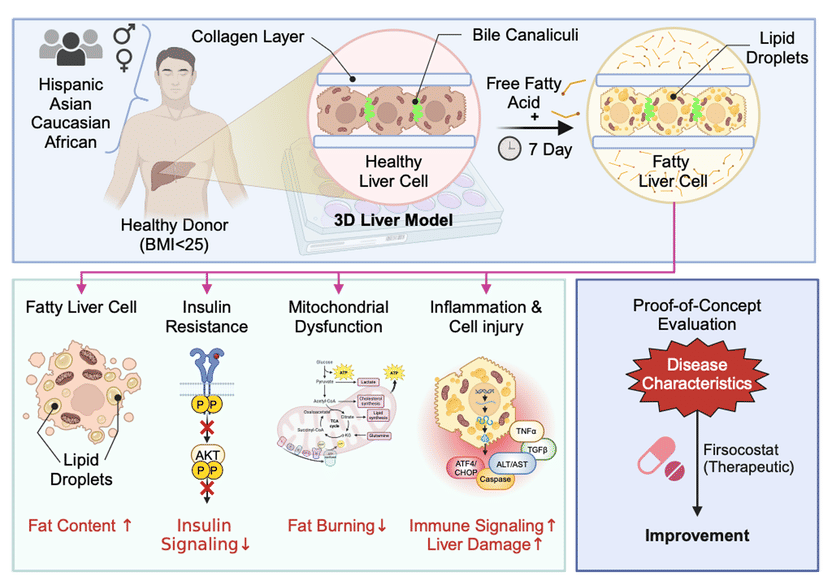
El sistema modelo: Se cultivan células hepáticas sanas de distinto origen en un sistema 3D de sándwich de colágeno y se induce su desarrollo hacia células de hígado graso utilizando ácidos grasos libres. Las células presentan todas las patologías típicas del hígado graso.
Image created using BioRender, Kwon Y et al.
El sistema modelo puede ayudar a identificar nuevas moléculas diana para el tratamiento del hígado graso. También puede servir para desarrollar estrategias de tratamiento que tengan en cuenta las diferencias de sexo y etnia entre los pacientes.
Las enfermedades hepáticas son uno de los mayores problemas de salud en todo el mundo y una de las causas más frecuentes de muerte. Las causas de las enfermedades hepáticas son variadas. A menudo tienen que ver con trastornos metabólicos y están asociadas a la obesidad y la diabetes. Una de cada cuatro personas padece una enfermedad hepática esteatósica asociada a disfunción metabólica (MASLD).
El número de enfermedades MASLD está aumentando en todo el mundo sin que se disponga de fármacos para esta indicación. Aún se están probando terapias dirigidas a diferentes vías de señalización molecular. Por lo tanto, las estrategias de tratamiento se centran en gran medida en eliminar las causas y los factores de riesgo que favorecen el desarrollo del hígado graso.
Sin embargo, estas medidas, que afectan al estilo de vida y la dieta, se asocian a un bajo cumplimiento por parte de los pacientes. Por ello, urge encontrar fármacos fiables y eficaces para tratar la enfermedad del hígado graso asociada a trastornos metabólicos.
El sistema desarrollado por un equipo de investigadores del Departamento de Principios Básicos de las Enfermedades Metabólicas del Centro Europeo de Angiociencia (ECAS), dirigido por la profesora Dra. Anja Zeigerer, difiere de otros modelos de cultivo celular in vitro en que utiliza hepatocitos humanos primarios en lugar de líneas celulares humanas inmortalizadas, que suelen emplearse en investigación. Las células aisladas directamente del hígado y cultivadas en un sistema de sándwich de colágeno en 3D tienen la ventaja de que conservan su morfología bipolar típica de las células hepáticas y, por tanto, también sus funciones específicas del tipo celular y metabólicas (metabolismo de azúcares y grasas).
Las células hepáticas proceden de varios donantes sanos. Un simple tratamiento con bajas concentraciones de ácidos grasos libres durante unos días es suficiente para convertir las células primarias en células hepáticas grasas típicas con las patologías características. Esto convierte a estos cultivos primarios de hepatocitos en un sistema in vitro ideal para estudiar la MASLD.
De hecho, el sistema modelo ya ha proporcionado una nueva perspectiva: contrariamente a la suposición científica de que la grasa de la dieta y la nueva síntesis de ácidos grasos en el hígado -además de las grasas libres del tejido adiposo- contribuyen al desarrollo de MASLD, este sistema demuestra que los ácidos grasos libres por sí solos son suficientes para simular de forma realista la enfermedad in vitro.
En la actualidad, la plataforma es principalmente un sistema de validación preclínica que puede utilizarse para investigar la eficacia de fármacos próximos al sistema humano. En futuros estudios, los investigadores de Mannheim utilizarán el sistema para estudiar con más detalle la enfermedad del hígado graso, por ejemplo investigando la contribución de distintos nutrientes a la patogénesis de la enfermedad.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
Yun Kwon, Pascal Gottmann, Surui Wang, Joel Tissink, Karsten Motzler, Revathi Sekar, Wiebke Albrecht, Cristina Cadenas, Jan G. Hengstler, Annette Schürmann, Anja Zeigerer; "Induction of steatosis in primary human hepatocytes recapitulates key pathophysiological aspects of metabolic dysfunction-associated steatotic liver disease"; Journal of Hepatology




















































