Los organoides pulmonares desvelan un secreto: cómo infectan los patógenos el tejido pulmonar humano
Nuevo sensor para vigilar las bacterias
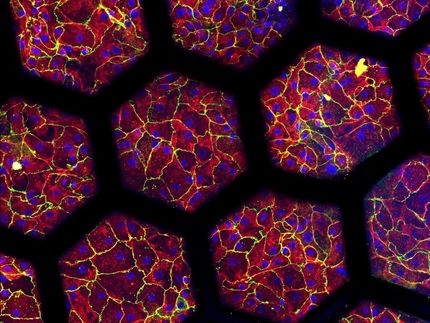
¿Cómo invaden los pulmones los patógenos? Utilizando microtejidos pulmonares humanos, un equipo del Biozentrum de la Universidad de Basilea ha descubierto la estrategia empleada por un peligroso patógeno. La bacteria se dirige a células pulmonares específicas y ha desarrollado una sofisticada estrategia para atravesar la línea de defensa de los pulmones.
A principios de este año, la OMS publicó una lista de doce de los patógenos bacterianos más peligrosos del mundo, resistentes a múltiples antibióticos y que suponen una grave amenaza para la salud humana. Esta lista incluye Pseudomonas aeruginosa, un patógeno nosocomial muy temido que causa neumonía grave y potencialmente mortal. Este patógeno amenaza especialmente a los pacientes inmunodeprimidos y a los que reciben ventilación mecánica, con tasas de mortalidad de hasta el 50%.
La barrera pulmonar es penetrable
Pseudomonas aeruginosa ha desarrollado una amplia gama de estrategias para invadir los pulmones y el organismo. Investigadores dirigidos por el profesor Urs Jenal, del Biozentrum de la Universidad de Basilea, han logrado ahora nuevos conocimientos sobre el proceso de infección utilizando microtejidos pulmonares cultivados en laboratorio y generados a partir de células madre humanas. En la revista científica Nature Microbiology, describen cómo las Pseudomonas penetran en la capa superior del tejido pulmonar e invaden zonas más profundas. Este estudio se realizó en el marco del Centro Nacional de Competencia en Investigación (NCCR) "AntiResist".
Nuestros pulmones están recubiertos por una fina capa de células apretadas que protege las capas más profundas del tejido pulmonar. La superficie está cubierta de mucosidad, que atrapa partículas como microorganismos y es eliminada de las vías respiratorias por células especializadas. Esta capa sirve de barrera eficaz casi impenetrable contra los patógenos invasores. Sin embargo, la bacteria Pseudomonas ha encontrado la forma de traspasarla. Hasta ahora, el modo en que el patógeno atraviesa la barrera tisular seguía siendo un misterio.
Los organoides pulmonares aportan nuevos conocimientos sobre las infecciones en humanos
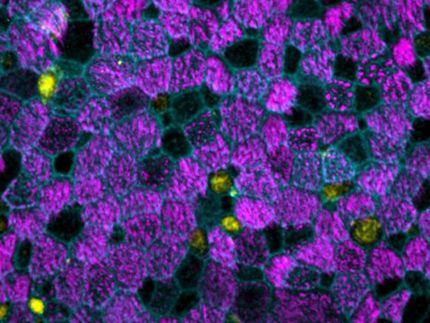
"Hemos cultivado microtejidos pulmonares humanos que imitan de forma realista el proceso de infección dentro del cuerpo de un paciente", explica Jenal. "Estos modelos pulmonares nos permitieron descubrir la estrategia de infección del patógeno. Utiliza las células caliciformes productoras de moco como caballos de Troya para invadir y atravesar el tejido de barrera. Al dirigirse a las células caliciformes, que constituyen sólo una pequeña parte de la mucosa pulmonar, la bacteria puede traspasar la línea de defensa y abrir la puerta."
Con un gran arsenal de factores de virulencia, conocidos como sistemas de secreción, el patógeno ataca e invade específicamente las células caliciformes, se replica en su interior y finalmente las mata. El estallido de las células muertas provoca roturas en la capa de tejido, lo que hace que la barrera protectora presente fugas. Los patógenos aprovechan este punto débil: Colonizan rápidamente los puntos de ruptura y se extienden a zonas más profundas del tejido.
Nuevo sensor para vigilar las bacterias
Utilizando organoides pulmonares humanos, los científicos han podido dilucidar las sofisticadas estrategias de infección de las Pseudomonas. Sin embargo, sigue sin estar claro cómo adaptan los patógenos su comportamiento durante el proceso de infección. Por ejemplo, primero deben ser móviles para extenderse por la superficie del tejido, luego adherirse rápidamente a las células pulmonares al entrar en contacto y, más tarde, activar sus factores de virulencia. Se sabe que las bacterias pueden modificar rápidamente su comportamiento gracias a pequeñas moléculas de señalización. Hasta ahora, sin embargo, no se disponía de la tecnología necesaria para estudiar estas correlaciones.
El equipo de Jenal ha desarrollado ahora un biosensor para medir y rastrear una pequeña molécula de señalización llamada c-di-GMP en bacterias individuales. El método se ha descrito recientemente en Nature Communications. "Se trata de un gran avance tecnológico", afirma Jenal. "Ahora podemos seguir en tiempo real y con alta resolución cómo se regula esta molécula de señalización durante la infección y cómo controla la virulencia del patógeno. Ahora tenemos una visión detallada de cuándo y dónde las células bacterianas individuales activan ciertos programas para regular su comportamiento. Este método nos permite investigar con más detalle las infecciones pulmonares".
Los modelos de órganos imitan las condiciones de los pacientes
"Gracias al desarrollo de organoides pulmonares humanos, ahora comprendemos mucho mejor cómo se comportan los patógenos en el tejido humano y, presumiblemente, en los pacientes", subraya Jenal. "Esto nos acerca un gran paso al objetivo del NCCR AntiResist". Los organoides del pulmón humano y otros órganos como la vejiga permiten a los investigadores estudiar los efectos de los antibióticos en el tejido, por ejemplo, identificando dónde y cómo sobreviven las bacterias durante el tratamiento. Estos modelos de órganos serán indispensables en el futuro para desarrollar estrategias nuevas y eficaces de lucha contra los patógenos.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
A. Leoni Swart, Benoît-Joseph Laventie, Rosmarie Sütterlin, Tina Junne, Luisa Lauer, Pablo Manfredi, Sandro Jakonia, Xiao Yu, Evdoxia Karagkiozi, Rusudan Okujava, Urs Jenal; "Pseudomonas aeruginosa breaches respiratory epithelia through goblet cell invasion in a microtissue model"; Nature Microbiology, 2024-6-10
Andreas Kaczmarczyk, Simon van Vliet, Roman Peter Jakob, Raphael Dias Teixeira, Inga Scheidat, Alberto Reinders, Alexander Klotz, Timm Maier, Urs Jenal; "A genetically encoded biosensor to monitor dynamic changes of c-di-GMP with high temporal resolution"; Nature Communications, Volume 15, 2024-5-9