La enzima con el corazón de hierro
Los resultados podrían conducir a nuevos biocatalizadores para la biotecnología sostenible
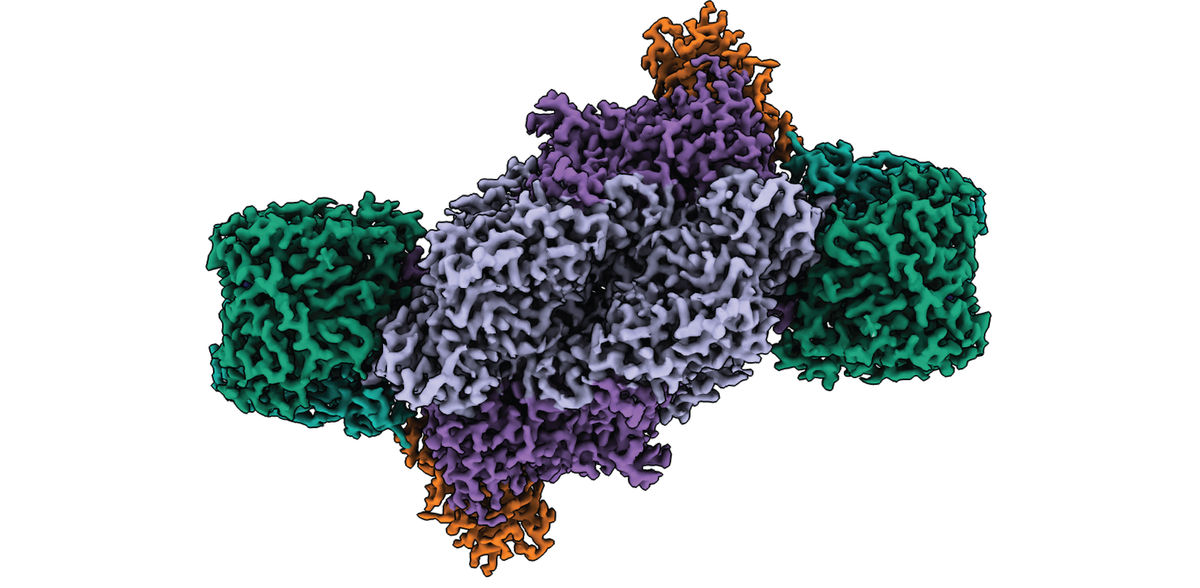
Las nitrogenasas son las únicas enzimas capaces de reducir el nitrógeno atmosférico a nitrógeno biodisponible (amoníaco), un proceso esencial para la vida en la Tierra. Mediante microscopía electrónica criogénica, investigadores del Instituto Max Planck de Microbiología Terrestre de Marburgo (Alemania) han resuelto la estructura completa del complejo de la nitrogenasa de hierro y han desvelado su singular arquitectura molecular. Sus hallazgos sientan las bases para comprender las relaciones estructura-función de esta importante enzima y podrían contribuir al desarrollo de nuevos biocatalizadores para la asimilación sostenible del nitrógeno y la conversión delCO2.
El nitrógeno forma parte de muchas biomoléculas importantes, como las bases de nuestro ADN y los aminoácidos que componen las proteínas y las enzimas. Antes de que el nitrógeno pueda formar parte de las biomoléculas, debe ser activado. En la naturaleza, sólo un único tipo de enzimas, las nitrogenasas, pueden realizar esta catálisis vital.
Las nitrogenasas también pueden procesarCO2
Recientemente se ha demostrado que las nitrogenasas también pueden reducir el dióxido de carbono (CO2) y el monóxido de carbono a hidrocarburos, como el metano o el etileno, lo que en principio ofrece una forma de reciclar los residuos de carbono en productos de hidrocarburos. Dentro de la familia de las nitrogenasas, la nitrogenasa de hierro (Fe) es la isoenzima con mayor actividad natural de reducción deCO2. Sin embargo, la arquitectura molecular que permite estas reacciones sigue siendo desconocida, un problema que el equipo del Dr. Johannes Rebelein, del Instituto Max Planck de Microbiología Terrestre, se propuso resolver.
Utilizando como organismo modelo una variante modificada de la bacteria púrpura no azufrada Rhodobacter capsulatus, los investigadores purificaron y caracterizaron bioquímicamente la nitrogenasa de Fe. Combinando la bioquímica anaeróbica y la microscopía electrónica criogénica en colaboración con la Instalación Central de Microscopía Electrónica del Instituto Max Planck de Biofísica de Fráncfort, han resuelto ahora la estructura de todo el complejo Fe Nitrogenasa.
Los resultados muestran que el cofactor del sitio activo, a diferencia de otros tipos de nitrogenasas, no contiene ningún metal distinto del hierro. Además, la arquitectura de la Fe nitrogenasa revela propiedades estructurales distintas que pueden ser responsables de las propiedades catalíticas únicas de la Fe nitrogenasa.
Diferencias que van más allá del centro activo
"Esperábamos que la principal diferencia entre la nitrogenasa de Fe y otras formas de nitrogenasa, como la nitrogenasa de molibdeno, fuera la arquitectura del cofactor del sitio activo y su entorno inmediato. Nos sorprendió ver que, a pesar de las diferencias en sus propiedades catalíticas, los sitios activos de las tres isoformas de nitrogenasa son en realidad muy similares", afirma Frederik Schmidt, estudiante de doctorado en el laboratorio de Johannes Rebelein y coprimer autor del estudio. Pero si no hay diferencias llamativas en torno al sitio activo, ¿qué características podrían explicar la reactividad única de esta enzima?
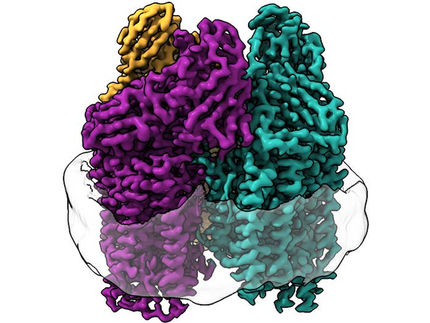
Los investigadores apuntan a dos características estructurales: En primer lugar, la enzima tiene una subunidad adicional denominada subunidad G. Aunque esta subunidad ya se había descrito con anterioridad, su función seguía siendo imprecisa. Basándose en su nueva estructura, los investigadores del Max Planck proponen tres posibles funciones para la subunidad G, entre ellas la coordinación de la transferencia de electrones, la canalización de sustratos y la estabilización del cofactor del sitio activo.
Mayor reactividad gracias a una simetría alterada
Las nitrogases son enzimas cuya función se consigue mediante la interacción de dos mitades simétricas. Sin embargo, cuando los investigadores superpusieron la estructura de la Fe-nitrogenasa a la estructura ya resuelta de la Mo-nitrogenasa, descubrieron que la simetría de esta última era diferente. "Se supone que las dos mitades simétricas se comunican entre sí para coordinar el mecanismo catalítico de la enzima. La simetría alterada que observamos en la Fe nitrogenasa podría explicar su particular reactividad", explica Luca Schulz, co-primer autor del estudio.
Cómo influyen exactamente estas diferencias estructurales en el mecanismo catalítico de la Fe nitrogenasa será una cuestión clave para el futuro". Los investigadores esperan seguir dilucidando el mecanismo molecular de la enzima, lo que podría contribuir al desarrollo de nuevos biocatalizadores para la asimilación sostenible del nitrógeno y la conversión delCO2.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.