Un láser de rayos X descubre la estructura de un insecticida natural contra los mosquitos
Una proteína bacteriana actúa contra más especies de mosquitos de las que se creía
Un equipo internacional de investigación ha analizado con precisión atómica una toxina producida de forma natural contra los insectos utilizando el láser de rayos X más potente del mundo. Los datos obtenidos en el XFEL europeo ayudan a averiguar el modo de acción del insecticida, producido por una bacteria. Esta información puede conducir al desarrollo de variaciones personalizadas del insecticida que se adapten mejor a insectos destructivos específicos, como los mosquitos que actúan como vectores de enfermedades. El equipo, dirigido por Dominik Oberthür, del DESY, y Colin Berry, de la Universidad de Cardiff (Reino Unido), presenta sus hallazgos en la revista Proceedings of the National Academy of Sciences(PNAS).
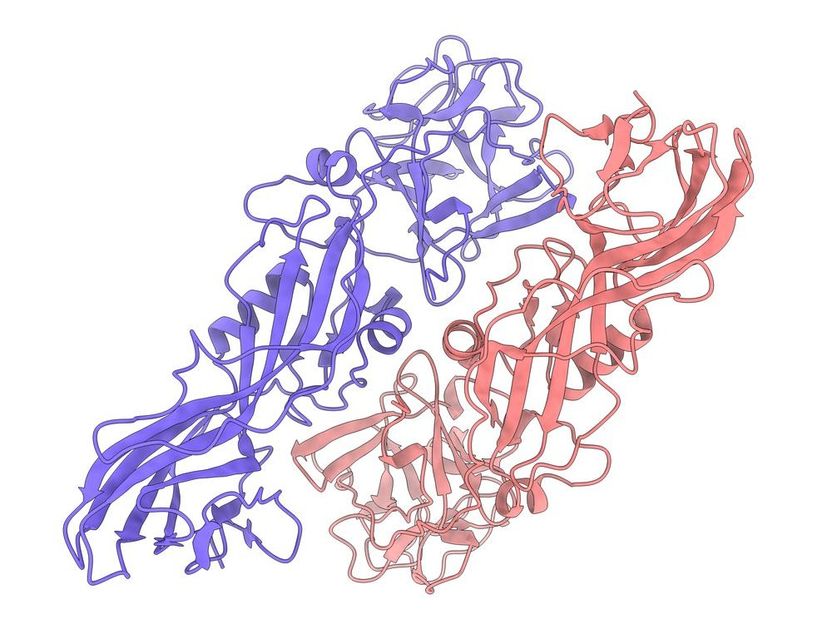
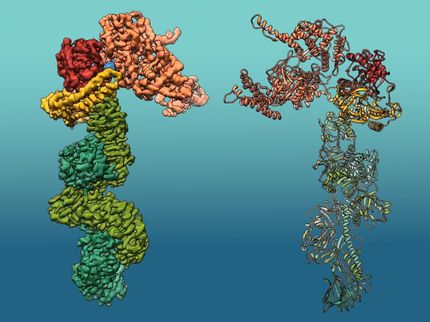
Estructura de la proteína insecticida natural Tpp49Aa1. La estructura se determinó mediante el análisis de los nanocristales naturales formados por el organismo que genera la proteína, la bacteria Lysinibacillus sphaericus.
D. Oberthür, DESY
La proteína insecticida analizada se denomina Tpp49Aa1 y es producida por la bacteria del suelo Lysinibacillus sphaericus. Se sabía que era venenosa, en combinación con otra proteína llamada Cry48, para el mosquito doméstico del sur Culex quinquefasciatus, que propaga varios patógenos como los virus del Zika y del Nilo Occidental. "En realidad, el insecticida funciona en más especies de mosquitos de las que pensábamos en un principio, como ha demostrado nuestra investigación", informa el bioquímico Berry. Los colaboradores del proyecto también probaron la toxina en varias especies de mosquito como parte de este estudio. Descubrieron que la Tpp49Aa1, en combinación con la Cry48, también tiene un efecto tóxico sobre el mosquito de la malaria Anopheles stephensi, el mosquito tigre asiático Aedes albopictus y el mosquito de la encefalitis occidental Culex tarsalis, autóctono de California.
"La información sobre la estructura detallada de la toxina revela pistas sobre cómo podría adherirse al organismo para producir su efecto", explica Oberthür. "Eso abre la posibilidad de alterarla para que se una aún más específicamente a un sitio de interacción en una especie concreta". Eso no sólo es interesante para la lucha contra los vectores de enfermedades, sino también para la agricultura, donde varias toxinas bacterianas se utilizan desde hace tiempo y ha crecido un gran mercado. En ambos casos, la toxina debe actuar lo más específicamente posible sobre el insecto plaga objetivo y prescindir de todos los demás organismos.
Para obtener la estructura de la proteína, los investigadores utilizaron pequeños cristales de proteína producidos por la propia bacteria. Estos cristales suelen tener un tamaño inferior a la mitad de una milésima de milímetro. Para iluminar este tipo de cristales se necesita una luz de rayos X extremadamente brillante y coherente de pulso corto, que sólo un láser de rayos X puede generar. La luz de rayos X es dispersada por el cristal, y el patrón resultante permite calcular la estructura de los componentes básicos del cristal, en este caso, las proteínas de la toxina.
Para obtener una imagen completa de la proteína, hay que iluminar el cristal desde todos los lados. Sin embargo, la luz láser de rayos X incidente destruye inmediatamente el cristal. Por ello, los investigadores utilizan una técnica, denominada cristalografía de femtosegundos en serie, en la que se analiza una plétora de cristales y se combinan los resultados en una sola imagen. Cuantos más datos se tomen, mayor será la precisión del análisis. Gracias a la altísima velocidad de repetición del XFEL europeo, el equipo pudo combinar imágenes tomadas de unos dos millones de diminutos cristales en su estación experimental SPB/SFX. Los cálculos produjeron una imagen detallada de la proteína con una resolución de 0,162 nanómetros (un nanómetro es la millonésima parte de un milímetro), lo que corresponde al diámetro de un átomo de carbono.
"Los insecticidas naturales podrían desempeñar un papel clave en la lucha contra las enfermedades o quizá en la protección de las cosechas frente a las plagas", explica Oberthür. "Con los pulsos láser de rayos X, extremadamente brillantes e intensos, pudimos investigar cristales no modificados del insecticida y describir su estructura. Esto podría ayudar en el futuro a dilucidar cómo se desarrolla la resistencia contra los insecticidas en los insectos."
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.