Virus zombi en un viaje de secuestro
Antiguas secuencias latentes en el genoma afectan al desarrollo embrionario de forma inesperada
El genoma de los mamíferos contiene secuencias retrovirales que se encuentran en un estado no muerto, pero mayoritariamente "inofensivo". Un equipo internacional de investigación ha descubierto recientemente cómo algunos de estos fragmentos de genes retrovirales afectan a las células embrionarias si se liberan. Inesperadamente, no son las proteínas virales, sino las copias del propio material genético las que generan un desequilibrio en la célula.

Imagen simbólica
Computer-generated image
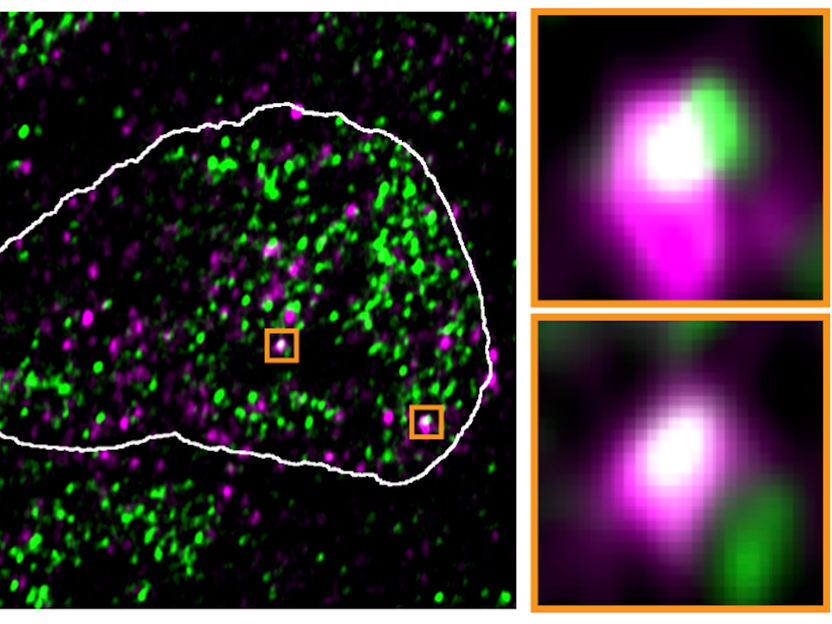
En el núcleo de las células madre de ratón, las moléculas de ARN endoviral desreprimidas (púrpura) aparecen en los mismos puntos que los condensados que contienen ARN polimerasa II (verde), como muestra esta imagen de microscopía de fluorescencia
Asimi et al., MPIMG

A lo largo de miles de años de evolución, innumerables virus se han incrustado en nuestro genoma. Un asombroso diez por ciento de los genomas de los mamíferos está formado por antiguas secuencias retrovirales. Éstas ya no parecen suponer ningún peligro, porque la mayoría de ellas han mutado hasta volverse irreconocibles. Además, estos genes han sido silenciados epigenéticamente por la célula. Pero al fallar el silenciamiento de los restos virales, éstos se levantan de sus tumbas, provocando el caos en la célula.
"Descubrimos que las copias mensajeras de algunos de los genes virales, el ARN, tienen un impacto importante en las células embrionarias", afirma Denes Hnisz, jefe del grupo de investigación del Instituto Max Planck de Genética Molecular (MPIMG) de Berlín. "Las secuencias virales parecen recordar su misión original de secuestrar la maquinaria molecular que asegura el flujo de información del ADN al ARN y a la proteína. Curiosamente, el propio ARN mensajero parece ser el responsable".
El equipo de Hnisz y los investigadores colaboradores publicaron sus resultados en la revista Nature Genetics. Describen que el ARN de los virus resucitados ejerce fuerzas de atracción sobre las enzimas que leen la información del ADN. Las tareas de la célula embrionaria -como la lectura de genes embrionarios importantes- se descuidan y se produce un desequilibrio fatal. Este estado desencadenado se da, por ejemplo, en algunos tipos de cáncer y enfermedades neurológicas.
Restos virales casi inofensivos
Los virus son fragmentos de información genética inteligentemente construidos. Algunos de ellos se incorporan al genoma de sus huéspedes y persisten en él. Miles de copias de retrovirus endógenos (ERV) se han extendido por los genomas de los mamíferos, a menudo en grupos de cientos de copias repetitivas.
"Como los retrovirus saltan de una sección de ADN a otra durante su ciclo vital, pueden alterar los genes e incluso recombinarlos. Esto los convierte en una importante herramienta de la evolución para crear nuevos genes", afirma Henri Niskanen, uno de los científicos que participan en el estudio. "Sin embargo, para un organismo individual, la modificación incontrolada de genes no es un buen augurio, especialmente durante el desarrollo embrionario".
Por ello, la célula identifica las secuencias de ERV y recluta maquinaria represiva específica en sus lugares y las mantiene en silencio. Además, el cromosoma se compacta en estos sitios.
Los virus resucitados secuestran la maquinaria transcripcional
Pero, ¿qué ocurre si se desactivan estos mecanismos de protección? El equipo de investigación quería averiguar qué es lo primero que ocurre cuando los zombis del ERV ya no se mantienen a raya. Para ello, eliminaron Trim28, una proteína que se encarga de silenciar los restos virales, de las células madre embrionarias de los ratones, y observaron las consecuencias inmediatas.
Una vez que Trim28 desapareció, la célula leyó sin sorpresa más genes del ERV, produciendo copias de ARN con la ayuda de la enzima ARN polimerasa. Pero, inesperadamente, la polimerasa desapareció simultáneamente de los genes de la célula madre que son especialmente importantes para la potencia de la misma.
"En cada célula sólo se dispone de un conjunto limitado de enzimas polimerasas y otros factores necesarios", afirma Christina Riemenschneider, otra investigadora del equipo. Si se transcriben demasiados genes al mismo tiempo, competirán por los limitados recursos, afirma. En un experimento, las repeticiones de secuencias del ERV compitieron con los genes de las células madre. "Vemos que las repeticiones de ERV tienen una afinidad ligeramente mayor: alejan la maquinaria de los genes embrionarios, creando un desequilibrio", dice Riemenschneider.
Fuerzas de atracción entre moléculas
La ARN polimerasa y otros factores necesarios que se acoplan selectivamente a los genes suelen reunirse en forma de gotas que contienen muchas proteínas y flotan en el núcleo celular, de forma parecida a las gotas de aceite de una ensalada. Estos "condensados" contienen muchas de las moléculas necesarias para la lectura de los genes y se sienten especialmente atraídos por segmentos específicos de ADN que controlan los genes más importantes de una célula.
Los genes del ERV, o más bien las moléculas de ARN producidas con estos genes, parecían secuestrar literalmente los condensados. En las imágenes microscópicas de alta resolución, a menudo se encontraban en los mismos lugares que los genes del ERV reactivados. Una vez eliminado el ARN viral de las células, las gotas volvían a su ubicación original.
Los efectos del ARN similar al virus no se limitaban al nivel molecular. Trabajando en embriones tempranos de ratón, el equipo de investigación demostró que el desplazamiento de los condensados hacia los ERV tenía efectos adversos en el desarrollo. Las células madre, por ejemplo, perdieron su propiedad típica de poder desarrollarse en cualquier otra célula porque los genes necesarios ya no estaban activos.
Relevante para la evolución y el desarrollo de enfermedades
"Es bastante sorprendente que los genes no codificantes y no funcionales tengan un efecto tan profundo a través del ARN", afirma el científico Abhishek Sampath Kumar, que participó en el trabajo. "Al pensar en retrovirus que se integran en el genoma, uno podría imaginarse daños en el ADN o partículas virales, pero no es el caso en esta ocasión".
En consecuencia, el equipo de científicos afirma que su hallazgo sitúa la investigación sobre los retrovirus endógenos bajo una nueva luz. "El secuestro de los condensados transcripcionales por parte de los ERV y su ARN es un importante hallazgo mecanístico que debería tenerse en cuenta en futuros estudios sobre elementos transponibles y sus reguladores epigenéticos", afirma el investigador Vahid Asimi, que ha trabajado en el estudio. "Esta podría ser una vía adicional que los ERVs utilizan para contribuir a la innovación evolutiva".
"La reactivación de los ERV está claramente vinculada a patologías, desde la obesidad a diversos tipos de cáncer y a enfermedades neurológicas como la esclerosis lateral amiotrófica y la esquizofrenia", añade el jefe del grupo, Denes Hnisz. "Esperamos que nuestra investigación ayude a dilucidar las causas moleculares de estas enfermedades".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
Asimi V, Sampath Kumar A, Niskanen H, Riemenschneider C, Hetzel S, Naderi J, Fasching N, Popitsch N, Du M, Kretzmer H, Smith ZD, Weigert R, Walther M, Mamde S, Meierhofer D, Wittler L, Buschow R, Timmermann B, Cisse II, Ameres SL, Meissner A, Hnisz D. Hijacking of transcriptional condensates by endogenous retroviruses. Nat Genet. 2022 Aug;54(8):1238-1247.





















































