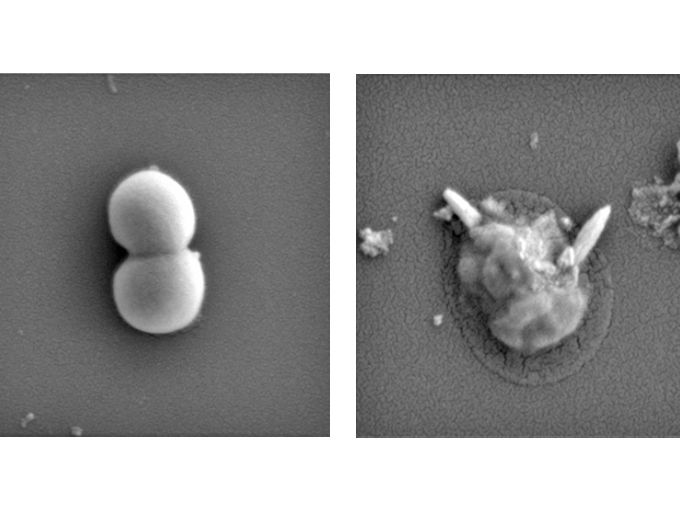
La vía de señalización Hippo hace que las células vuelvan a ser felices: ¿Posibilidades para rejuvenecer las células madre?
Programa de acondicionamiento para las células madre de la sangre: la proteína TAZ protege de la pérdida de función relacionada con la edad
Un sistema inmunitario que funcione bien es esencial para la protección contra las infecciones. Sin embargo, con el aumento de la edad, el funcionamiento del sistema inmunitario disminuye, lo que también se debe a los daños relacionados con la edad en las células madre hematopoyéticas (de la sangre). Investigadores del Instituto Leibniz sobre el Envejecimiento - Instituto Fritz Lipmann (FLI) de Jena (Alemania) han descubierto ahora cómo el coactivador de la vía de señalización Hippo, la proteína TAZ, puede proteger a las células madre hematopoyéticas del envejecimiento y evitar así que pierdan su función. Además, las células madre hematopoyéticas envejecen de forma muy heterogénea. Además de células viejas, también se pueden encontrar células "jóvenes" cuando el mecanismo de protección ha funcionado eficazmente.
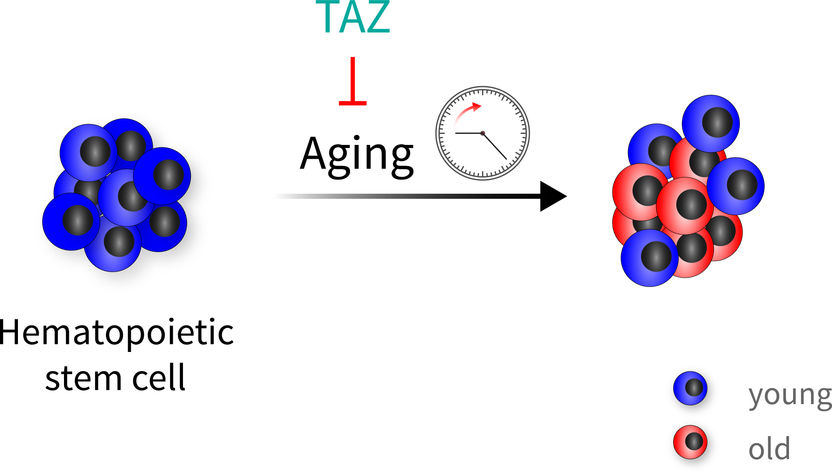
Las células madre hematopoyéticas envejecen de forma muy heterogénea. La proteína TAZ, un coactivador de la vía de señalización Hippo, puede proteger a las células madre sanguíneas del envejecimiento. Así, además de células viejas, también se encuentran células "jóvenes" cuando la protección ha funcionado.
FLI / Björn von Eyss

Computer generated picture

Nuestra sangre se regenera constantemente a partir de células madre hematopoyéticas (HSC). Sin embargo, con la edad, estas células madre sanguíneas experimentan una pérdida de función y su potencial regenerativo disminuye. En las personas mayores hay otro problema con la formación de la sangre (hematopoyesis): forman menos linfocitos (células del sistema inmunitario), por lo que a menudo ya no son capaces de enfrentarse tan bien a las infecciones y no suelen mostrar una respuesta inmunitaria muy eficaz tras una vacunación.
Ya hay numerosos indicios de que estas deficiencias asociadas a la vejez son consecuencia, sobre todo, de los daños que se producen en las células madre de la sangre a causa de la edad. Todavía no se sabe cómo se produce este daño ni si existen mecanismos de protección que puedan proteger a las células madre sanguíneas de él. En un estudio publicado recientemente en Nature Communications, investigadores del Instituto Leibniz sobre el Envejecimiento - Instituto Fritz Lipmann (FLI) y del Hospital Universitario de Jena (Alemania); de la Universidad de Harvard en Cambridge (Massachusetts); y del ERIBA en Groninga (Países Bajos), han utilizado ahora novedosos métodos analíticos a nivel unicelular para investigar con más detalle qué ocurre durante el proceso de envejecimiento en las células madre hematopoyéticas y qué papel desempeña la proteína TAZ en este proceso.
La vía de señalización Hippo hace que las células vuelvan a ser felices
El cuerpo adulto sustituye miles de millones de células cada día; en este proceso, las células existentes son reemplazadas continuamente por "nuevas" células. "Mantener el equilibrio entre la división, la diferenciación y la muerte de las células es tremendamente importante, porque incluso los más pequeños desequilibrios alteran este balance y, tarde o temprano, contribuyen al desarrollo del cáncer o pueden conducir a un envejecimiento prematuro", explica el Dr. Björn von Eyss, jefe del grupo de investigación "Control transcripcional de la homeostasis tisular" en el FLI.
La vía de señalización Hippo desempeña un papel fundamental en la regeneración de los tejidos, pero también en el desarrollo del cáncer. Controla la división celular en los órganos y tejidos y garantiza que adquieran y mantengan el tamaño y la forma adecuados. "La vía de señalización Hippo protege las células del cuerpo. Es como si las hiciera felices de nuevo cuando están expuestas al estrés celular", añade el Dr. von Eyss. "Muchos genes de la vía de señalización Hippo también están regulados al alza en la vejez, pero hasta ahora se sabe poco sobre el papel que desempeñan estos procesos en el envejecimiento".
La actividad de YAP/TAZ es importante para la regeneración de los tejidos
La vía de señalización Hippo inhibe la actividad de proteínas como YAP(proteína asociada a Yes) y TAZ(coactivador transcripcional con motivo de unión a PDZ). Se trata de proteínas que controlan la copia de ciertos genes del ADN en ARN mensajero (ARNm), un proceso llamado transcripción. Estudios recientes han demostrado que YAP y TAZ también son esenciales para la regeneración de tejidos en el intestino o el hígado, ya que ayudan a las células a afrontar mejor el estrés derivado del daño tisular reprogramándolas a un estado más primitivo.
"Dado su importante papel en la regeneración, analizamos la expresión génica en las células madre hematopoyéticas de ratones jóvenes y viejos y comprobamos qué genes se regulan al alza o a la baja con el envejecimiento", informa KyungMok Kim, estudiante de doctorado en el laboratorio del Dr. Björn von Eyss. "Descubrimos que los genes de las células cambian con el envejecimiento. En las células de los ratones viejos, la proteína TAZ estaba más inducida como coactivador de la vía Hippo, y varios cientos de genes estaban regulados al alza". El cambio más llamativo relacionado con el envejecimiento se produjo en el gen Clca3a1, por lo que los investigadores utilizaron este gen inducido por TAZ como marcador sensible para sus estudios posteriores.
Curiosamente, el producto del gen CLCA3A1 es una proteína que se encuentra en la superficie de las células y que es inducida por la proteína TAZ. Utilizando anticuerpos contra la CLCA3A1, el grupo de investigación de von Eyss consiguió identificar una población específica de células que expresan niveles altos o bajos de CLCA3A1. Mediante el uso de métodos especiales de células individuales, como RNA-Seq o ATAC-Seq de células individuales, en la instalación central de "secuenciación" del Instituto, también fue posible rastrear la actividad de TAZ en cada célula individual a nivel celular y monitorizarla directamente in vivo.
Las células madre sanguíneas envejecen de forma heterogénea
Los investigadores descubrieron así que las células madre sanguíneas no envejecen de manera uniforme. Por el contrario, son muy heterogéneas y presentan poblaciones mixtas. Así, fue posible aislar subpoblaciones de ratones viejos en las que las células eran predominantemente viejas, pero también poblaciones en las que las células estaban en un estado "juvenil". El patrón de expresión génica de estas células también tendía a parecerse al de las células madre hematopoyéticas jóvenes. Esto es un indicio de que la TAZ puede contrarrestar en cierta medida la pérdida gradual de la función de las células madre y proteger las células madre sanguíneas rejuveneciéndolas. En consecuencia, la desregulación genética de TAZ en las HSC viejas dio lugar a un drástico fracaso en la restauración del sistema sanguíneo tras el trasplante de estas HSC.
¿Posibilidades de rejuvenecimiento de las células madre?
"Nuestros nuevos hallazgos abren perspectivas completamente nuevas para hacer que las células madre vuelvan a estar en forma", afirma KyungMok Kim, resumiendo los resultados de la investigación. "Por un lado, si logramos filtrar selectivamente las células madre sanguíneas viejas de las más jóvenes y aislarlas del cuerpo, podríamos utilizarlas para impulsar el sistema inmunitario y hacerlo significativamente más activo de nuevo". Este enfoque para rejuvenecer las células madre se estudiará con más detalle en un proyecto de seguimiento financiado por la Asociación Leibniz.
"Por otra parte, los resultados podrían ayudarnos a entender mejor por qué envejecemos de forma tan diferente y por qué hay diferencias entre la edad biológica y la cronológica", añade el Dr. Björn von Eyss. Aunque las células tengan cronológicamente la misma edad, envejecen de forma diferente.
Sin embargo, si el reloj epigenético no funciona de la misma manera en todas las células del cuerpo, esto podría explicar las diferencias resultantes en la edad biológica de las células. La epigenética describe los marcadores químicos del genoma que no influyen en la secuencia de los bloques de construcción del ADN, sino que determinan cómo y qué genes se leen. Este tipo de información también se transmite cuando las células se dividen y cambia con el envejecimiento. La heterogeneidad celular -como se muestra en este estudio en las células madre hematopoyéticas- podría ser el resultado de diferentes marcadores epigenéticos en las subpoblaciones. La comprensión funcional de estos marcadores en las células madre hematopoyéticas podría, por tanto, aportar pistas sobre el proceso de envejecimiento y las enfermedades asociadas a él.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
Taz protects hematopoietic stem cells from an aging-dependent decrease in PU.1 activity. Kim KM, Mura-Meszaros A, Tollot M, Krishnan MS, Gründl M, Neubert L, Groth M, Rodriguez-Fraticelli A, Svendsen AF, Campaner S, Andreas N, Kamradt T, Hoffmann S, Camargo FD, Heidel FH, Bystrykh LV, de Haan G, von Eyss B. Nat Commun. 2022, 13(1), 5187