Mantener a raya las células cancerosas agresivas
Una observación sorprendente
Las células tumorales con mutaciones en el gen BRCA1/2 suelen sobrevivir al tratamiento, ya sea quimio o radioterapia, porque pueden reparar el daño en el ADN inducido por la terapia. Un equipo dirigido por Claus Scheidereit, del Centro Max Delbrück, ha informado ahora en The EMBO Journal de cómo el bloqueo de la proteína TSG101 impide a estas células tumorales llevar a cabo procesos de reparación.
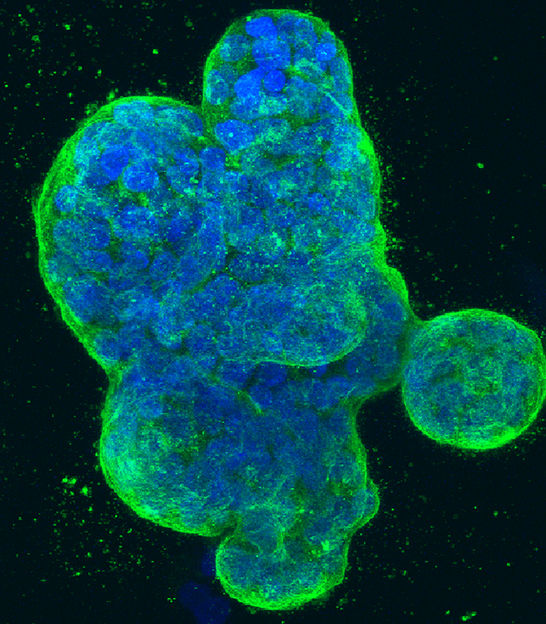
Cultivo tridimensional de células de cáncer de mama humano, con el ADN teñido de azul y una proteína en la membrana de la superficie celular teñida de verde.
NCI Center for Cancer Research, National Cancer Institute, National Institutes of Health , CC BY-NC 2.0 (https://creativecommons.org/licenses/by-nc/2.0/)
Cada célula tiene dos "herramientas" diferentes para reparar las roturas de una o dos cadenas de ADN, que pueden ser inducidas por factores como las toxinas ambientales, la quimioterapia o la radiación ionizante. La primera consiste en los genes de reparación del ADN BRCA1 y BRCA2, mientras que la segunda es una enzima llamada poli (ADP-ribosa) polimerasa, o PARP1 para abreviar. Estas herramientas son utilizadas tanto por las células sanas como por las malignas. En definitiva, hacen lo mismo y pueden sustituirse mutuamente. Si la reparación del ADN falla porque el daño es demasiado extenso, la célula inicia su programa de suicidio -apoptosis- y se destruye a sí misma. Este proceso se ha convertido en un objetivo para los tratamientos contra el cáncer.
Las personas portadoras de mutaciones en los genes BRCA1 y/o BRCA2 tienen un riesgo muy elevado de desarrollar determinados tipos de tumores, sobre todo de mama, ovario y próstata. Estos individuos carecen de una de estas herramientas, lo que explica que sean más propensos a desarrollar células cancerosas. Además, estas células tumorales sólo disponen de una herramienta, la PARP1, para garantizar su supervivencia. Sin embargo, los tumores asociados a BRCA1/2 suelen ser muy agresivos y difíciles de tratar. Por ello, los investigadores dirigidos por el profesor Claus Scheidereit del Centro Max Delbrück, último autor del estudio, examinaron detenidamente la vía de señalización que activa la enzima PARP1. En el proceso, descubrieron una forma de apuntar y hacer inútil esta herramienta.
Para evitar la apoptosis tras un daño en el ADN, entra en acción una vía de señalización clave llamada NF-κB. Ésta inicia la transcripción de genes en el núcleo de la célula que, en última instancia, activan la PARP1 para que la célula pueda reparar el daño. Al desactivar los genes uno por uno, Ahmet Tufan, coautor del estudio junto con Katina Lazarow, del Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP), examinó todo el genoma humano en busca de genes que regulen esta vía de señalización. Para ello, primero introdujo en el genoma un "gen de medición", que proporciona el plano para una etiqueta de proteína fluorescente. "Unas horas después de que el tratamiento con el agente quimioterapéutico etopósido haya inducido daños en el ADN, las células se iluminan de color verde porque el NF-κB está activado", explica Tufan. Una gran cantidad de muestras de los 20.000 genes se iluminaron, pero otras no. Esto se debió a que en estas muestras un gen que desempeña un papel importante en la vía de señalización estaba aparentemente desactivado.
Obstaculizando la reparación del PARP1
¿Pero cuál? El número de genes candidatos se contaba por miles; después de todo, la vía de señalización NF-κB controla una amplia gama de funciones celulares, como la respuesta inmunitaria. "Utilizamos la bioinformática para eliminar los que realizaban tareas rutinarias de "mantenimiento de la casa" en la célula, y luego sometimos los 500 genes restantes al mismo procedimiento una vez más". El equipo volvió a utilizar etopósido para inducir daños en el ADN. "Para cada gen, realizamos pruebas paralelas utilizando la citoquina TNF-alfa, que también activa esta vía de señalización pero sólo entra en juego cuando hay inflamación", dice Scheidereit.
Después de esto, sólo quedaba un pequeño grupo de genes. Los investigadores ya sabían que algunos de ellos formaban parte de la vía de señalización, pero otros no. ¿Cuál era el crucial? Tufan utilizó algoritmos para buscar pistas en varias bases de datos. ¿Dónde se mencionaban los productos de estos genes junto a otros? ¿Existe algún documento que afirme que las proteínas en cuestión se unen a otras para formar complejos? El equipo también buscó en las propias bases de datos del laboratorio. Entonces, de repente, encontraron lo que buscaban: el gen de susceptibilidad tumoral 101 (TSG101). Este gen no era un descubrimiento nuevo en sí mismo; desempeña muchas funciones conocidas en la célula. Pero en este proceso concreto, se une a PARP1 tan pronto como la enzima se ha acoplado en el lugar del daño. Entonces, y sólo entonces, la propia PARP1 puede activarse.
"La PARP1 es como una pistola cargada", dice Scheidereit. "Tanto si se limita a arañar las células, como si se les aplica una tensión de cizallamiento o se las destroza por completo, la PARP1 se activa. Pero si no hay TSG101 en la célula, no funciona. Le falta el gatillo, por así decirlo". Los investigadores pudieron observar lo que ocurría en directo bajo el microscopio utilizando PARP1 teñida con fluorescencia. Unos segundos después de haber quemado diminutos agujeros en el núcleo de la célula con un láser, las células se iluminaron de color verde mientras la PARP1 entraba en el núcleo de la célula desde todos los lados y se unía a los sitios de daño del ADN. Al cabo de unos minutos, el brillo se atenuó.
Una observación sorprendente
"La PARP1 se modifica a sí misma, atrae a otras proteínas auxiliares que llevan a cabo las reparaciones necesarias y luego se desprende", explica Scheidereit. Sin embargo, si se desactiva el gen TSG101, la PARP1 se dirige a los lugares del núcleo celular donde se ha producido el daño en el ADN con la misma rapidez, pero el brillo verde se mantiene. La PARP1 no era capaz de liberarse del ADN dañado. "De todas las observaciones que hice durante los experimentos de imagen de células vivas, ésta fue la más sorprendente", dice Tufan. "En las células sin TSG101, la PARP1 quedó realmente atrapada en los lugares de daño del ADN".
"Con esta investigación, hemos demostrado que la administración de inhibidores de PARP y la desactivación de TSG101 tienen el mismo efecto", resume Scheidereit. Utilizando varias líneas celulares de cáncer de mama, los investigadores también pudieron demostrar en el laboratorio que las células sin el gen TSG101 morían rápidamente tras la quimioterapia. Sin embargo, las células que perecieron más rápido fueron las que tenían mutaciones en el gen BRCA1, ya que no tenían ninguna herramienta para reparar el ADN.
Los inhibidores de PARP ya se utilizan desde hace años en el tratamiento de ciertos tipos de cáncer, por ejemplo, en las terapias para pacientes con cáncer de mama con una mutación BRCA demostrada. "Desgraciadamente, todavía no se ha desarrollado ningún inhibidor que se dirija específicamente a PARP1, ya que hay todo un grupo de genes PARP", dice Scheidereit. "Sin embargo, basándonos en nuestros resultados, ahora puede iniciarse una búsqueda dirigida de agentes terapéuticos que bloqueen la unión de TSG101 a PARP1". Por tanto, el estudio puede allanar el camino para el futuro desarrollo de terapias altamente eficaces y más específicas para los cánceres asociados a BRCA1/2.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.