La palmitoilación, un nuevo objetivo para los fármacos contra el cáncer
Al desarrollar una herramienta para visualizar la asociación con la membrana y el estado de activación de las proteínas normales y oncogénicas, los científicos de la UNIGE han establecido la base para el descubrimiento de fármacos innovadores
Las proteínas periféricas de membrana tienen la particularidad de unirse temporalmente a las membranas celulares, paso necesario para que puedan cumplir su función biológica. Para ello, entran en acción ciertas enzimas que catalizan su modificación lipídica. Este proceso se denomina "palmitoilación". Algunas de estas proteínas pueden mutar y convertirse en oncogénicas, como las proteínas RAS, responsables de aproximadamente un tercio de los cánceres. Para entender cómo funciona la palmitoilación y utilizarla con fines terapéuticos, científicos de la Universidad de Ginebra (UNIGE), en Suiza, desarrollaron una novedosa herramienta para visualizar este proceso en células vivas. Han demostrado que, en contra de lo que se pensaba, la palmitoilación es posible no sólo en el aparato de Golgi, el lugar habitual de procesamiento y entrega de las proteínas, sino también en el lugar mismo donde éstas deben actuar, es decir, la membrana plasmática. Este descubrimiento, que se podrá leer en la revista Nature Communications, abre el camino a estrategias innovadoras de descubrimiento de fármacos para dirigirse con gran precisión a la unión a la membrana -y por tanto a la actividad- de las proteínas oncogénicas.
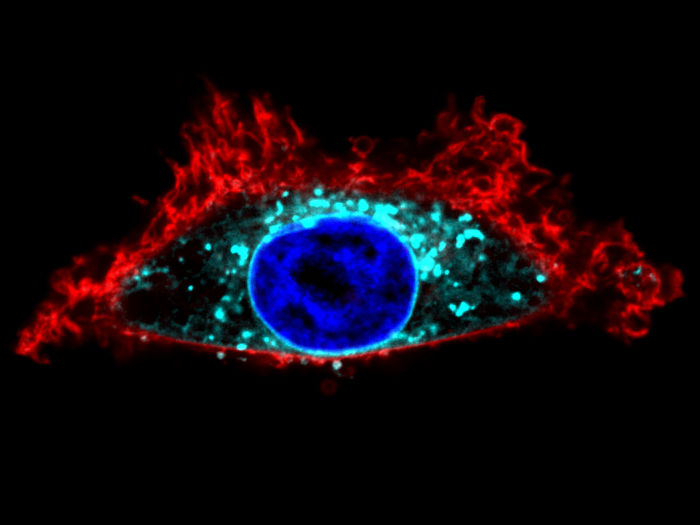
Visualización con la herramienta SwissKASH de una célula HeLa de la línea celular. La proteína Gαo (en turquesa) se recluta en la membrana del núcleo (en azul).
Gonzalo Solis / UNIGE
La palmitoilación consiste en la introducción de ácidos grasos en determinadas proteínas para que puedan unirse a las membranas celulares. Este mecanismo se rige por reglas precisas, que dependen de la secuencia de cada tipo de proteína y de la presencia de enzimas especializadas. Hasta ahora, la comunidad científica creía que la palmitoilación de las proteínas de la membrana periférica sólo podía tener lugar en un lugar de la célula, el aparato de Golgi.
"Efectivamente, estas proteínas se producen en el citosol -el fluido celular- y luego 'nadan' hasta el aparato de Golgi, donde se modifican antes de ser transportadas a donde tienen que actuar", explica Gonzalo Solís, investigador del Departamento de Fisiología Celular y Metabolismo de la Facultad de Medicina de la UNIGE, y autor principal de este trabajo. "Sin embargo, planteamos la hipótesis de la posibilidad de una palmitoilación local, sin pasar por el aparato de Golgi. Si esto es cierto, se abren posibilidades completamente nuevas para la intervención de este mecanismo".
Observación y manipulación de las proteínas
Para comprobar esta hipótesis, el equipo de investigación dirigido por Vladimir Katanaev, profesor del Departamento de Fisiología Celular y Metabolismo y del Centro de Investigación Traslacional en Onco-Hematología de la Facultad de Medicina de la UNIGE, se centró en una proteína llamada Gαo, que normalmente se localiza en la membrana plasmática y el aparato de Golgi.
La metodología utilizada es completamente nueva: "Llevamos las enzimas palmitoiladoras a un compartimento totalmente diferente de la célula, la membrana nuclear", explica Gonzalo Solís. "Se reclutó Gαo en la membrana nuclear, lo que nos permitió identificar la enzima específica que las palmitoila. Confirmamos así que este proceso puede tener lugar en el mismo sitio en el que la proteína es necesaria."
A diferencia de las metodologías bioquímicas habituales, la herramienta desarrollada por Vladimir Katanaev y su equipo, a la que han llamado SwissKASH, es también la primera que mantiene la célula viva y permite observar el proceso de forma dinámica. "Hasta ahora no había ninguna alternativa a la destrucción de la célula", afirma Vladimir Katanaev. "Nuestro método también permite determinar con exactitud qué proteína reacciona con qué enzima a nivel local, lo cual es esencial si queremos controlar este mecanismo con fines terapéuticos".
Una nueva diana farmacológica
Varias proteínas de la membrana periférica, y en particular las proteínas de la subunidad Gα y las proteínas RAS, son susceptibles de sufrir mutaciones y adquirir así un potencial oncogénico agresivo. Su oncogenicidad depende de su capacidad para unirse a la membrana plasmática; la palmitoilación desempeña así un papel clave en la transformación de una célula sana en una cancerosa.
"Inhibir la enzima que induce la palmitoilación, e impedir que la proteína oncogénica se una a la membrana plasmática, podría por tanto desactivar su patogenicidad", señala Gonzalo Solís. "Así, podemos imaginar el bloqueo de esta reacción específica sin desequilibrar todo el sistema". Los científicos pretenden ahora automatizar esta metodología para estudiar el efecto de toda una serie de productos farmacéuticos sobre la palmitoilación de oncoproteínas seleccionadas, así como comprobar su toxicidad en la célula completa.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.