La investigación describe el principio fundamental de la catálisis enzimática
Cómo la igualdad de cargas en las enzimas controla las reacciones bioquímicas
Es bien sabido en física y química que las cargas iguales se repelen, mientras que las opuestas se atraen. Durante mucho tiempo se asumió que este principio también se aplicaba cuando las enzimas -los catalizadores biológicos de todos los organismos vivos- formaban o rompían enlaces químicos. Se pensaba que las enzimas colocan cargas en sus "centros activos", donde se producen realmente las reacciones químicas, de tal forma que repelen cargas similares de las demás moléculas que las rodean. Este concepto se conoce como "tensión electrostática". Por ejemplo, si el sustrato (la sustancia sobre la que actúa la enzima) tiene una carga negativa, la enzima podría utilizar una carga negativa para "estresar" al sustrato y facilitar así la reacción. Sin embargo, un nuevo estudio realizado por la Universidad de Gotinga y el Instituto Max Planck de Ciencias Multidisciplinares de Gotinga ha demostrado ahora que, en contra de lo esperado, dos cargas iguales no conducen necesariamente a la repulsión, sino que pueden provocar la atracción en las enzimas. Los resultados se han publicado en la revista Nature Catalysis.
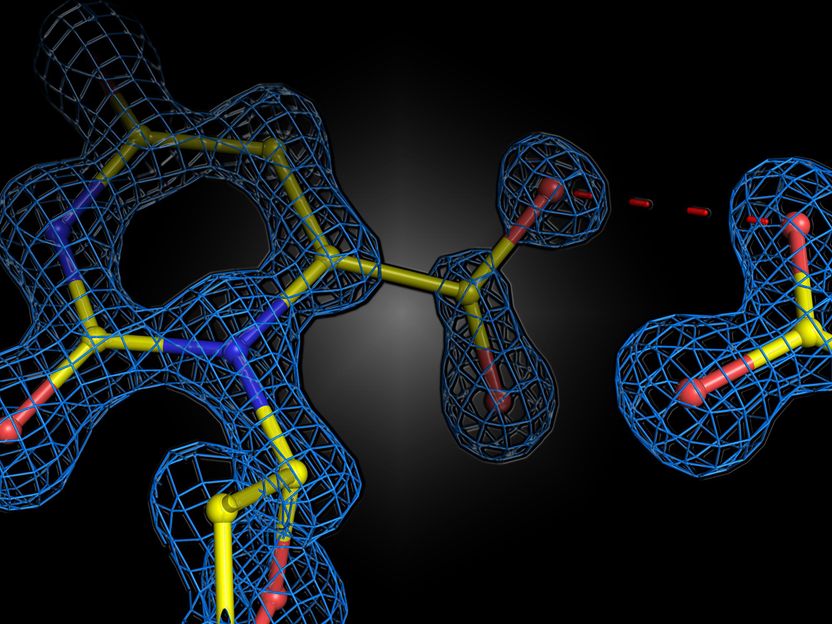
Instantánea estructural de la reacción enzimática en la enzima humana orotidina 5'-fosfato descarboxilasa. Las dos cargas negativas del sustrato y la enzima no se repelen, sino que forman una interacción atractiva.
Kai Tittmann
El equipo investigó una enzima muy conocida que se ha estudiado ampliamente y es un ejemplo de libro de texto de la catálisis enzimática. Sin la enzima, la reacción es extremadamente lenta: de hecho, la mitad del sustrato tardaría 78 millones de años en reaccionar. La enzima acelera esta reacción1017 veces, simplemente colocando cargas negativas y positivas en el centro activo. Dado que el sustrato contiene un grupo cargado negativamente que se desprende en forma de dióxido de carbono, durante décadas se supuso que las cargas negativas de la enzima servían para tensar el sustrato, que también está cargado negativamente, y acelerar la reacción. Sin embargo, este hipotético mecanismo seguía sin demostrarse porque la estructura de la reacción era demasiado rápida para poder observarla.
El grupo del profesor Kai Tittmann, del Centro de Biociencias Moleculares de Gotinga (GZMB), ha conseguido ahora, por primera vez, utilizar la cristalografía de proteínas para obtener una instantánea estructural del sustrato poco antes de la reacción química. Inesperadamente, las cargas negativas de la enzima y el sustrato no se repelían. En cambio, compartían un protón, que actuaba como una especie de pegamento molecular en una interacción atractiva. "La cuestión de si dos cargas iguales son amigas o enemigas en el contexto de la catálisis enzimática ha sido controvertida durante mucho tiempo en nuestro campo, y nuestro estudio muestra que los principios básicos del funcionamiento de las enzimas están todavía muy lejos de ser comprendidos", dice Tittmann. Las estructuras cristalográficas fueron analizadas por el químico cuántico Ricardo Mata y su equipo del Instituto de Química Física de la Universidad de Gotinga. "El protón adicional, que tiene una carga positiva, entre las dos cargas negativas no sólo se utiliza para atraer a la molécula implicada en la reacción, sino que desencadena una cascada de reacciones de transferencia de protones que aceleran aún más la reacción", explica Mata.
"Creemos que estos principios recién descritos de la catálisis enzimática ayudarán al desarrollo de nuevos catalizadores químicos", dice Tittmann. "Dado que la enzima que estudiamos libera dióxido de carbono, el gas de efecto invernadero más importante producido por las actividades humanas, nuestros resultados podrían ayudar a desarrollar nuevas estrategias químicas para la fijación del dióxido de carbono".
En el estudio participaron científicos del Centro de Biociencias Moleculares de Gotinga (GZMB), la Facultad de Biología y Psicología y la Facultad de Química de la Universidad de Gotinga, así como el Instituto Max Planck de Ciencias Multidisciplinares, el Laboratorio Europeo de Biología Molecular (EMBL) de Hamburgo y la Universidad de Toronto. La publicación está dedicada a la memoria del coautor, el profesor Ulf Diederichsen, fallecido el año pasado.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.