Atrápame si puedes: cómo se administran las terapias de ARNm en las células
Nuevos conocimientos sobre el desarrollo de terapias de ARN para lograr un suministro eficaz y dosis más bajas
Los investigadores han descubierto dónde y cómo llega el ARNm a una célula para modificar o entregar información genética, un proceso crucial para el desarrollo de nuevas terapias.
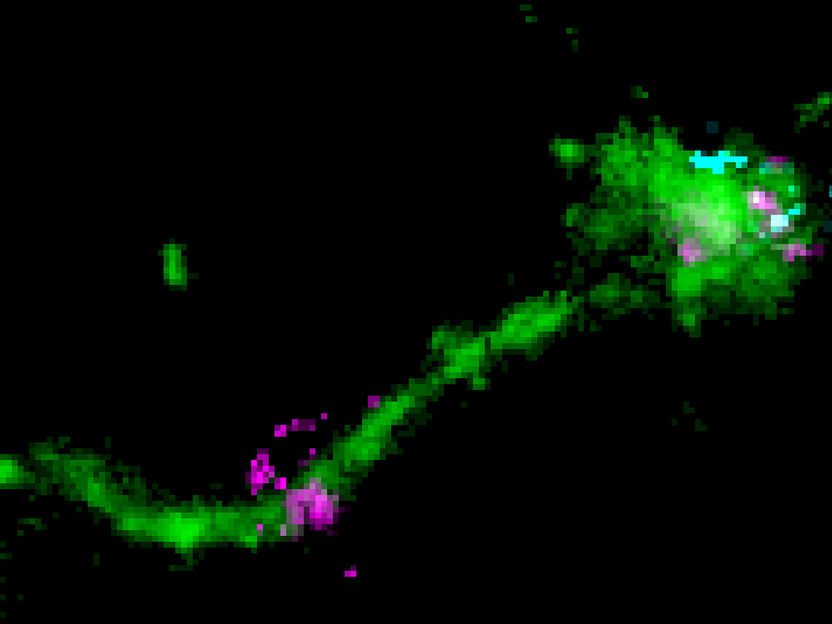
Un LNP se localiza en un túbulo endosomal largo (verde), junto con una señal perpendicular de ARNm disperso (cian), y que probablemente representa un caso de escape de ARNm (púrpura).
Marino Zerial / MPI-CBG
En los últimos años, el ácido ribonucleico (ARN) ha surgido como una poderosa herramienta para el desarrollo de nuevas terapias. El ARN se utiliza para copiar la información genética contenida en nuestro material hereditario, el ácido desoxirribonucleico (ADN), y luego sirve de plantilla para construir proteínas, los componentes básicos de la vida. La introducción del ARN en las células sigue siendo un reto importante para el desarrollo de nuevas terapias en una amplia gama de enfermedades. Investigadores del Instituto Max Planck de Biología Celular Molecular y Genética (MPI-CBG) de Dresde, junto con investigadores de la compañía biofarmacéutica mundial AstraZeneca, han investigado dónde y cómo se transporta el ARNm dentro de la célula. Descubrieron que el ARNm utiliza una puerta de entrada inesperada. Sus resultados aportan nuevas ideas para el desarrollo de terapias de ARN con el fin de lograr un suministro eficaz y dosis más bajas.
El ADN (ácido desoxirribonucleico) contiene la información genética necesaria para el desarrollo y el mantenimiento de la vida. Esta información se comunica mediante el ácido ribonucleico mensajero (ARNm) para fabricar proteínas. Las terapias basadas en el ARNm tienen el potencial de abordar necesidades no satisfechas para una amplia variedad de enfermedades, incluyendo el cáncer y las enfermedades cardiovasculares. El ARNm puede ser entregado a las células para desencadenar la producción, la degradación o la modificación de una proteína objetivo, algo imposible con otros enfoques. El ARNm puede introducirse en nanopartículas lipídicas (LNP) -pequeñas burbujas de grasa- que protegen el ARNm y lo transportan al interior de las células. Sin embargo, este proceso no es sencillo, porque el ARNm tiene que atravesar la membrana antes de llegar a su lugar de acción en el interior de la célula, el citoplasma.
Los investigadores del equipo del director del MPI-CBG, Marino Zerial, son expertos en visualizar las vías de entrada de moléculas en la célula, como el ARNm, con microscopios de alta resolución. Se asociaron con científicos de AstraZeneca que proporcionaron a los investigadores prototipos de nanopartículas lipídicas que habían desarrollado para enfoques terapéuticos para seguir el ARNm dentro de la célula. El estudio se publica en el Journal of Cell Biology.
"Para ser entregado, el ARNm debe hacer un largo viaje. Encerrado en la burbuja de la LNP grasa, tiene que entrar primero en la célula", explica Marino Zerial. "Las LNP llegan a la superficie celular, donde se unen a los receptores. A continuación, se introducen en unos compartimentos especializados encerrados en la membrana, llamados endosomas. En este punto, el ARNm está dentro de las células pero rodeado por dos barreras, la burbuja de grasa y la pared del endosoma o, más correctamente, la membrana. El reto del ARNm es escapar de ambas barreras para llegar al citoplasma, donde sirve de molde para fabricar proteínas. Sabemos que sólo una pequeña fracción de las moléculas de ARN son capaces de escapar al citoplasma". Las moléculas de carga internalizadas, como las LNP, se transportan primero a los endosomas "tempranos". Estos son centros logísticos que distribuyen las moléculas de carga a varios destinos en la célula. Reciben las moléculas hacia la superficie celular o las degradan en los endosomas tardíos y los lisosomas. Hasta ahora se pensaba que el ARNm escapaba de los endosomas tardíos aprovechando su contenido muy ácido. "Con técnicas de microscopía de una sola molécula", explica Prasath Paramasivam, primer autor del estudio, "pudimos visualizar por primera vez el ARNm en el LNP dentro de los endosomas de las células. También captamos el escape real del ARNm, que se produjo en los túbulos de los endosomas de reciclaje, que son sólo ligeramente ácidos". "Nuestros resultados implican que enviar el ARNm de la LNP a los endosomas tardíos es contraproducente para la entrega y sólo aumenta la toxicidad celular", dice Zerial. Estos hallazgos ayudan a comprender con más detalle el mecanismo de escape del ARNm de los endosomas.
Marino Zerial resume: "El sistema de entrega de ARNm por PNL requiere dosis elevadas debido a la baja eficiencia de escape endosómico. Saber adónde va el ARNm y cómo puede escapar de los endosomas nos permite desarrollar mejores vehículos para una entrega más eficiente, con una dosis menor. Podemos mejorar el sistema de entrega de ARNm para que pueda utilizarse en aplicaciones terapéuticas, por ejemplo en el tratamiento del cáncer".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
Prasath Paramasivam, Christian Franke, Martin Stöter, Andreas Höijer, Stefano Bartesaghi, Alan Sabirsh, Lennart Lindfors, Marianna Yanez Arteta, Anders Dahlen, Annette Bak, Shalini Andersson, Yannis Kalaidzidis, Marc Bickle, and Marino Zerial; "Endosomal escape of delivered mRNA from endosomal recycling tubules visualized at the nanoscale"; J Cell Biol; 2021: e202103003





















































