Distanciamiento de las proteínas
Los investigadores han desarrollado un nuevo método para adherir proteínas a la superficie de partículas similares a los virus
Los investigadores del Instituto Paul Scherrer PSI son los primeros en haber unido dos proteínas mediante un enlace rígido y autónomo. El elemento estructural mantiene unidas las dos moléculas de proteína a una distancia y un ángulo definidos, de forma muy parecida a como el mango de una pesa conecta dos pesos. Este tipo de enlace podría ayudar, por ejemplo, a desarrollar las llamadas partículas similares a los virus para las vacunas. Los investigadores publican sus resultados en la revista Structure.
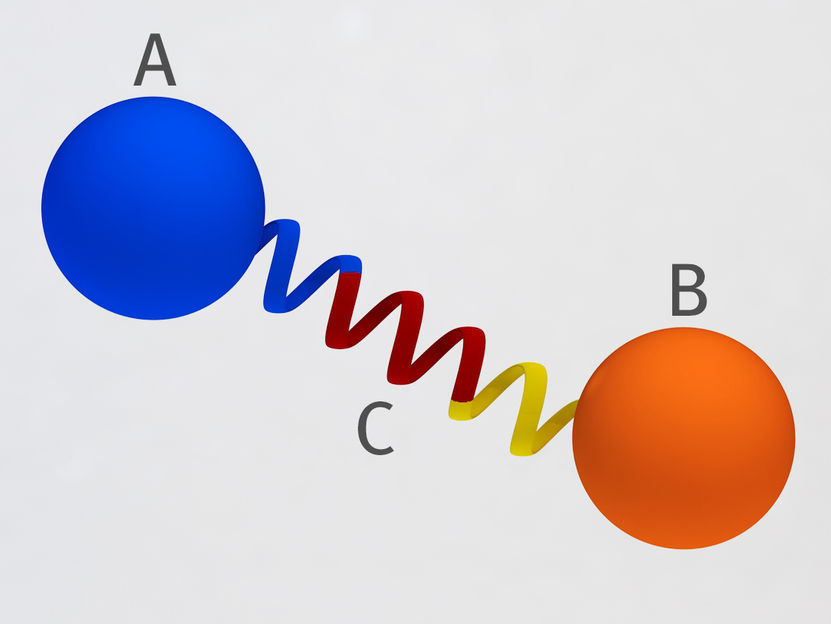
Principio del puente proteico desarrollado en el PSI: Dos proteínas (A y B) están conectadas entre sí a una distancia y ángulo fijos por medio de una espiral proteica rígida (C). Así, no pueden acercarse la una a la otra y no pueden interactuar.
Mahir Dzambegovic, Paul Scherrer Institut
"Las proteínas se han optimizado en la evolución durante millones de años", afirma el biólogo molecular Roger Benoit, del Laboratorio de Biología a Nanoescala del PSI. "En la naturaleza, donde las proteínas tienen que ser rígidas, lo son. Pero es difícil imitar eso en el laboratorio".
Si se quiere unir dos proteínas y a la vez mantenerlas a una distancia y un ángulo definidos mediante un puente proteico, es difícil. El elemento de unión suele ser demasiado flexible, lo que permite que las dos proteínas se acerquen demasiado entre sí. Es como si uniéramos dos pesos con una cuerda. En cuanto se levanta la cuerda para que las pesas puedan oscilar libremente, se juntan. Sin embargo, cuando las moléculas de las proteínas se acercan unas a otras, pueden interactuar. Los contactos entre las proteínas suelen restringir la libertad natural de movimiento de la estructura: las moléculas se mueven de forma diferente a como lo harían si no hubiera contacto con la otra proteína.
Podría haber muchas aplicaciones para los enlaces con menor flexibilidad, pero diseñarlas es difícil. "A menudo es difícil predecir cómo se pliegan las proteínas y cómo es su estructura en la realidad", dice Benoit. Es decir, encadenar varias proteínas con el espaciado y la orientación deseados suele requerir una optimización extremadamente compleja en el laboratorio.
Roger Benoit y su equipo han encontrado ahora una solución. Han utilizado un segmento de una proteína que interviene, por ejemplo, en la cicatrización de heridas en el cuerpo humano. Parte de esta proteína forma una hélice, una forma espiral. Su columna vertebral se estabiliza gracias a las interacciones entre sus cadenas laterales. Así, la hélice permanece intacta por sí sola y es bastante rígida, casi como una espiral metálica de acero endurecido. Con ello, Benoit consiguió unir varias proteínas entre sí de la forma deseada.
En términos de la analogía de la pesa, eso significa que los investigadores han unido las proteínas utilizando una espiral de metal en lugar de una cuerda, manteniendo así la distancia entre ellas constante. De este modo, también fijan la orientación de las dos proteínas entre sí.
Aportaciones para nuevas vacunas
Estas conexiones rígidas tienen potencial para muchas aplicaciones prácticas. Entre otras cosas, podrían resultar útiles para el desarrollo de vacunas contra los virus, incluido el Sars-CoV-2.
Las vacunas suelen producirse haciendo que los patógenos sean inactivos. Ya no pueden dañar a los humanos, pero estimulan el sistema inmunitario para que produzca anticuerpos. Las partículas similares a los virus preparadas en el laboratorio son otra opción. Muchas proteínas superficiales características de un virus se adhieren a las superficies de estas partículas similares a los virus, de modo que el sistema inmunitario las detecta y luego genera anticuerpos.
Una de las ventajas que ofrecen las partículas similares a los virus es que, al no contener material genético del patógeno, no hay posibilidad de que se multipliquen. Por esta razón, son más seguras que los patógenos debilitados, y actualmente se están investigando para la protección contra varios virus, como el de la hepatitis B y el del papiloma humano.
Con el conector rígido, las proteínas del virus podrían fijarse a la superficie de dichas partículas similares al virus con mayor precisión. La limitada flexibilidad de la hélice ofrece ventajas: "Si la conexión entre la partícula y la proteína del virus es demasiado flexible, las proteínas podrían volver a plegarse y entonces ya no serían accesibles", explica Benoit. El sistema inmunitario no las reconoce tan bien. Si las proteínas sobresalen más de las partículas y se presentan todas en un ángulo y a una distancia predeterminada, como es posible con el espaciador, se podrían desarrollar vacunas mejores y más eficaces.
Huesos y seda
Benoit espera que también se puedan crear nuevos biomateriales de esta manera. La hélice podría servir como bloque de construcción en combinación con otras proteínas. En el futuro, los investigadores podrían construir andamios de proteínas en 3D, por ejemplo, para sustituir un trozo de hueso. "O podrían utilizarla para combinar proteínas en largas cadenas y crear nuevos tejidos similares a la seda, que luego podrían ser incluso biodegradables".
Los investigadores del PSI y de los institutos de investigación de todo el mundo que trabajan en la elucidación estructural de las proteínas también deberían beneficiarse del nuevo método. Y es que las moléculas de proteína unidas mediante la hélice rígida podrían optimizarse para que cristalicen y, sin embargo, conserven su libertad de movimiento natural en los cristales. Esto facilitaría el examen de su estructura. Con los nuevos métodos de análisis estructural de cristales de proteínas, por ejemplo utilizando el láser de electrones libres SwissFEL del PSI, las proteínas pueden incluso observarse en acción, por ejemplo cuando las bombas de membrana transportan sustancias fuera de una célula.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.






















































