Cómo las arqueas consumidoras de etano recogen su plato favorito
Los científicos logran descifrar la estructura de la enzima responsable de la fijación del etano
Los respiraderos calientes de las profundidades marinas albergan microbios que se alimentan de etano. Los descubrieron recientemente los científicos del Instituto Max Planck de Microbiología Marina. Ahora los investigadores de Bremen han conseguido encontrar un componente importante en la conversión microbiana del gas. Han podido descifrar la estructura de la enzima responsable de la fijación del etano. La estructura pone de manifiesto algunos rasgos comunes con la homóloga que fija el metano, pero también reveló las características clave para la especialización del etano. Los resultados se han publicado ahora en Science.
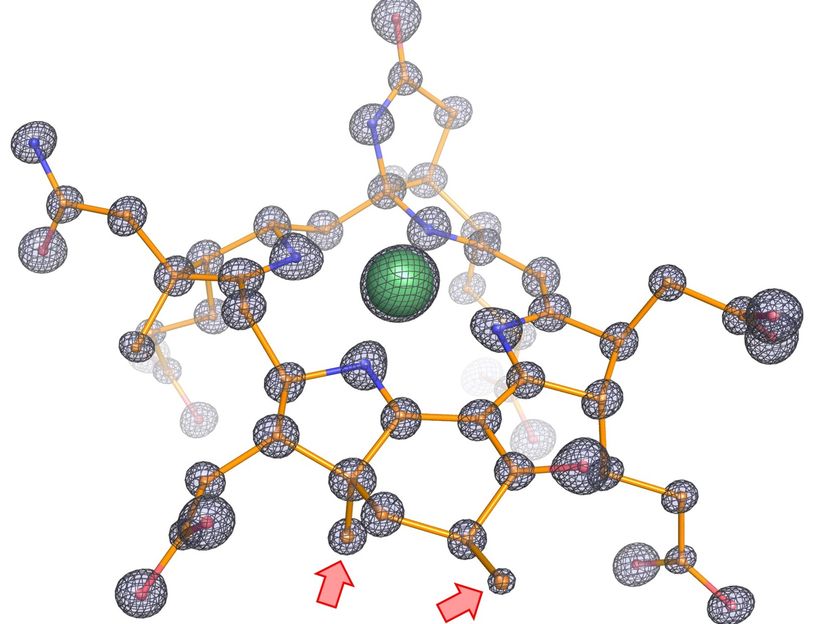
Estructura molecular del cofactor modificado de la enzima. La figura muestra la composición atómica del cofactor con carbono, nitrógeno, oxígeno y níquel representados como bolas y coloreados en naranja, azul, rojo y verde, respectivamente. Los palos representan los enlaces covalentes entre los átomos. La localización precisa de cada átomo individual fue posible gracias a la densidad de electrones muy nítida (malla negra). Este alto nivel de detalle reveló dos metilaciones adicionales en el cofactor, resaltadas por flechas rojas, estas metilaciones no existen en las enzimas especializadas para el metano.
© Max-Planck-Institut für Marine Mikrobiologie, O. Lemaire und T. Wagner
Este conocimiento es el resultado de la estrecha colaboración de varios grupos de investigación del Instituto Max Planck de Microbiología Marina. Un equipo en torno a Cedric Hahn y Gunter Wegener descubrió recientemente microbios degradadores de etano en los respiraderos hidrotermales de la cuenca de Guaymas, a 2.000 metros de profundidad en el Golfo de California. Lo llamaron Ethanoperedens thermophilum, que significa "devorador de etano amante del calor".
Cedric Hahn, estudiante de doctorado del grupo de investigación Ecología Molecular, cultivó los microbios degradadores de etano en el laboratorio. Hahn, Wegener y sus colegas del grupo de investigación Metabolismo Microbiano, Tristan Wagner y Olivier Lemaire, examinaron más de cerca estos microorganismos. Este trabajo de colaboración desveló los secretos que se esconden tras la fijación del etano. "Nos sorprendió lo que encontramos. Además de una similitud global, algunas características de la enzima difieren fundamentalmente de su homóloga, la enzima responsable de la degradación del metano", afirma Gunter Wegener, científico del Grupo de Investigación de Ecología y Tecnología de las Profundidades Marinas.
Los comedores de etano dependen de la misma enzima que los comedores de metano
En los sedimentos de las profundidades marinas, el calor geotérmico provoca la degradación de la materia orgánica en aceite y gases naturales como el etano. El etano es consumido por diferentes microorganismos que forman el llamado consorcio: las arqueas, que descomponen el gas natural, y las bacterias, que acoplan los electrones liberados en el proceso a la reducción del sulfato, un compuesto abundante en el océano. El descubrimiento de los microbios que se alimentan de etano ha supuesto un soplo de aire fresco para la investigación. En comparación con los microbios que comen metano, que tardan mucho en crecer, los especialistas en etano crecen mucho más rápido y se duplican cada semana. Así, se reduce el tiempo de producción de biomasa, lo que permite intentar la purificación y caracterización de las enzimas clave que catalizan la oxidación del gas natural.
Para comprobar las similitudes entre las enzimas que catalizan la activación del etano y del metano, Cedric Hahn añadió a su cultivo un conocido inhibidor molecular de la oxidación del metano. Este tratamiento suprimió también la oxidación del etano. "Esto sugirió que las arqueas oxidantes de etano activan el etano en reacciones enzimáticas similares a las que actúan en la degradación/generación del metano", dice Cedric Hahn. Este tipo de enzimas son una especialidad de Tristan Wagner, que las ha estudiado durante varios años.
Una estructura visualizada con un nivel de precisión asombroso
Cedric Hahn y Olivier Lemaire, los dos primeros autores del trabajo que ahora se publica en Science, intentaron entonces purificar la enzima responsable de la fijación del etano. "El proyecto fue un gran reto", dice Olivier Lemaire. "Normalmente purificamos las enzimas a partir de cantidades mucho mayores de biomasa de un cultivo que contiene un microorganismo. Sin embargo, finalmente obtuvimos cantidades suficientes de enzimas puras para los análisis estructurales".
El siguiente paso crítico fue obtener cristales de la enzima para determinar su estructura tridimensional. "La cristalografía de rayos X dio excelentes resultados previos en este grupo de enzimas", dice Tristan Wagner, jefe del grupo de investigación de Metabolismo Microbiano y experto en esta técnica. "Analizamos estos cristales por difracción de rayos X y resolvimos la estructura de la enzima con una resolución atómica sin precedentes. De este modo, podemos determinar la posición de los átomos individuales y obtener así una imagen extremadamente precisa de la estructura".
La estructura presenta varias características sin precedentes. "Nos dimos cuenta de que la cámara catalítica en la que tiene lugar la reacción química es dos veces más grande que en las enzimas que capturan metano, lo que tiene sentido si se tiene en cuenta que el etano es más grande que el metano", dice Olivier Lemaire. El cofactor, catalizador de la reacción, contiene dos grupos metilo adicionales. Estos grupos metilo fueron confirmados por Jörg Kahnt, del Instituto Max Planck de Microbiología Terrestre, experto mundial en este cofactor. "Encontramos una proteína que podría ser responsable de estas metilaciones, y sólo se encuentra en los consumidores de etano", dice Cedric Hahn. Como la cámara es más voluminosa, un cofactor normal simplemente no encajaría bien y perjudicaría la reacción. Las metilaciones en el cofactor lo anclan en la posición correcta.
Además, la enzima contiene un túnel que conecta el exterior con la cámara catalítica. Este túnel no existe en ninguna enzima similar caracterizada. Los investigadores demostraron experimentalmente la existencia de este túnel mediante una colaboración con Sylvain Engilberge en el Instituto Paul Scherrer de Suiza, donde los cristales de la proteína fueron gaseados con xenón. Se detectó xenón en la cámara catalítica y en el túnel de gas previsto, lo que demuestra su existencia. El túnel se mantiene y estabiliza mediante aminoácidos modificados y extensiones adicionales.
Ahora el foco de atención se centra en el propano y el butano
La estructura de la enzima ilustra cómo estos microbios procedentes de filtraciones geotérmicas se especializaron en la captura de etano. Este trabajo permite profundizar en el primer paso de la degradación del etano, la única fuente de energía de estas arqueas. "Nuestro hallazgo de que la enzima responsable del proceso tiene rasgos específicos para reconocer el etano en lugar de otros alcanos es un gran paso adelante, sin embargo la comprensión de todo el proceso de degradación está todavía muy lejos", concluye Tristan Wagner.
Así pues, ¿cómo se puede avanzar en la investigación? "Nuestros trabajos anteriores muestran que la activación de alcanos más largos requiere enzimas similares", dice Gunter Wegener. "Como siguiente paso, queremos investigar cuáles podrían ser las características específicas de las enzimas que catalizan la activación del propano y el butano".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.