Inanición de las células cancerosas con medicamentos
Los hallazgos sobre la medicación contra el cáncer revelan el mecanismo de regulación de las proteínas
Los fármacos inmunomoduladores, entre ellos los derivados del Contergan, la lenalidomida y la pomalidomida, han mejorado notablemente el tratamiento de enfermedades hematológicas malignas como el mieloma múltiple. Investigadores de la Universidad Técnica de Múnich (TUM) han descifrado ahora el modo de acción de esta clase de medicamentos. Al mismo tiempo, han identificado nuevas e innovadoras terapias dirigidas contra el cáncer.
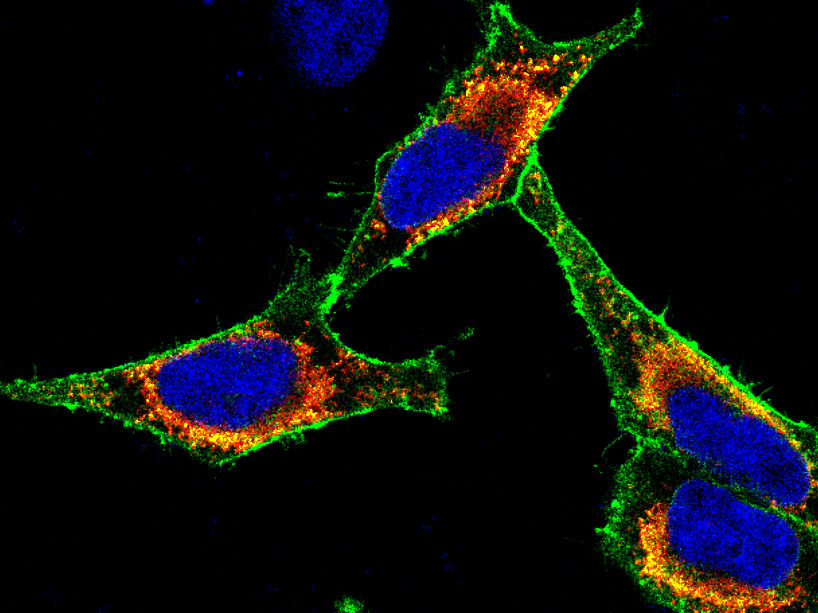
Imagen de inmunofluorescencia de células cancerosas en las que se ha marcado una proteína de membrana con un colorante verde fluorescente. El núcleo está marcado con un colorante azul.
F. Bassermann
El fármaco talidomida se vendía como sedante bajo el nombre comercial de Contergan en los años cincuenta y sesenta. En su momento, sus efectos secundarios provocaron uno de los mayores escándalos farmacéuticos de la historia: El medicamento se retiró del mercado tras conocerse que el uso de Contergan durante el embarazo había provocado más de 10.000 casos de defectos de nacimiento graves.
En la actualidad, los preparados sucesores, la lenalidomida y la pomalidomida, se prescriben bajo la estricta supervisión de oncólogos experimentados: los principios activos son la piedra angular de las terapias modernas contra el cáncer. El uso de la lenalidomida y la pomalidomida ha mejorado considerablemente la tasa de éxito de las terapias y la supervivencia de los pacientes, especialmente en el caso de las neoplasias hematológicas como el mieloma múltiple. Dado que estas sustancias pueden influir en el sistema inmunitario, se denominan fármacos inmunomoduladores (IMiD).
Muchas proteínas de membrana afectadas
Estudios anteriores han demostrado que los IMiD se unen a una proteína llamada cereblón, lo que provoca el mal funcionamiento de un complejo proteico en la superficie de las células tumorales, inhibiendo así el crecimiento del tumor. Un equipo de investigación dirigido por el profesor Florian Bassermann y Vanesa Fernández, del hospital universitario Klinikum rechts der Isar de la TUM, ha descifrado ahora el mecanismo exacto y el alcance de esta desregulación en un nuevo estudio.
Descubrieron que el cereblón apoya a la proteína HSP90 como lo que se conoce como una cochaperona; la HSP90 es responsable del correcto plegamiento de miles de proteínas en las células humanas. Los científicos pudieron demostrar que la función de apoyo de la co-captadora cereblon es específica para las proteínas de membrana. Estas proteínas, que están ancladas en la superficie de una célula, son esenciales para que las células tumorales crezcan: Permiten que las células se comuniquen con las vecinas, transmiten señales de crecimiento y absorben nutrientes importantes.
Tras el tratamiento con IMiD, el cereblón ya no puede unirse a la maquinaria HSP90 y, en consecuencia, pierde su función de apoyo en el control de calidad de las proteínas de membrana. "Mediante análisis de todo el proteoma, hemos podido demostrar que un gran número de proteínas esenciales de la superficie de las células cancerosas se desestabilizan con el tratamiento con IMiD", afirma el oncólogo Florian Bassermann. "Esto explica en última instancia los efectos inusualmente amplios de estas sustancias".
Células tumorales hambrientas
En el mieloma múltiple, las proteínas CD98hc y LAT1 se ven especialmente afectadas. Juntas, estas proteínas suelen garantizar el suministro de aminoácidos a las células cancerosas. Como las células cancerosas en el caso del mieloma múltiple tienen una necesidad especialmente alta de nutrientes como los aminoácidos, CD98hc y LAT1 son proteínas muy abundantes en estas células. El equipo de investigación ha demostrado ahora que el tratamiento con IMiD reduce significativamente la captación de aminoácidos esenciales e inhibe así el crecimiento de las células tumorales. "Esto hace que las células cancerosas pasen literalmente hambre", explica Michael Heider, primer autor del estudio.
Nuevas opciones terapéuticas dirigidas
El descubrimiento de que las células del mieloma múltiple pueden ser atacadas dirigiéndose a las proteínas CD98hc y LAT1 abre nuevas posibilidades de terapias innovadoras en este cáncer actualmente incurable. Junto con Wolfgang Weber, catedrático de medicina nuclear de la TUM, los investigadores probaron una molécula dirigida a CD98hc, conocida como anticalina. La molécula fue desarrollada recientemente por Arne Skerra, profesor de química biológica de la TUM. Los resultados muestran que la molécula se une específicamente a la proteína de la superficie celular CD98hc tanto en cultivos celulares como en modelos de ratón. Por tanto, esta anticalina podría utilizarse en el futuro para la terapia dirigida y el diagnóstico. "Ya se están planificando los primeros estudios clínicos para seguir evaluando la anticalina", afirma Bassermann.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
Heider M., Eichner R., Stroh J., Morath V., Kuisl A., Zecha J., Lawatscheck J., Baek K., Garz A.K., Rudelius M., Deuschle F.C., Keller U., Lemeer S., Verbeek M., Götze K.S., Skerra A., Weber W.A., Buchner J., Schulman B.A., Kuster B., Fernández-Sáiz V., Bassermann F.; "The IMiD target CRBN determines HSP90 activity towards transmembrane proteins essential in multiple myeloma"; Molecular Cell; 2021