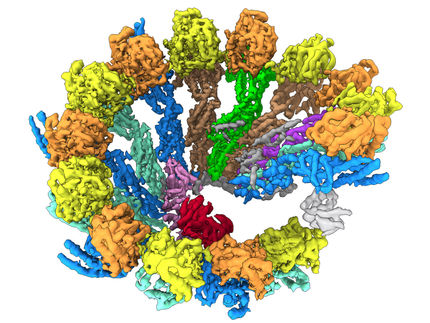
Congelado: La tecnología de punta revela las estructuras dentro de las células
Los nuevos métodos permiten a los científicos del IST de Austria echar un vistazo al interior de las células: las imágenes de alta resolución de las células congeladas muestran estructuras que antes sólo se podían adivinar. Las temperaturas de menos 196 grados centígrados permiten obtener imágenes de alta resolución del interior de la célula. Los investigadores del Instituto de Ciencia y Tecnología (IST) de Austria son así capaces de mostrar por primera vez cómo la forma activa de un complejo proteínico juega papeles críticos en la motilidad celular y en otras funciones biológicas importantes.
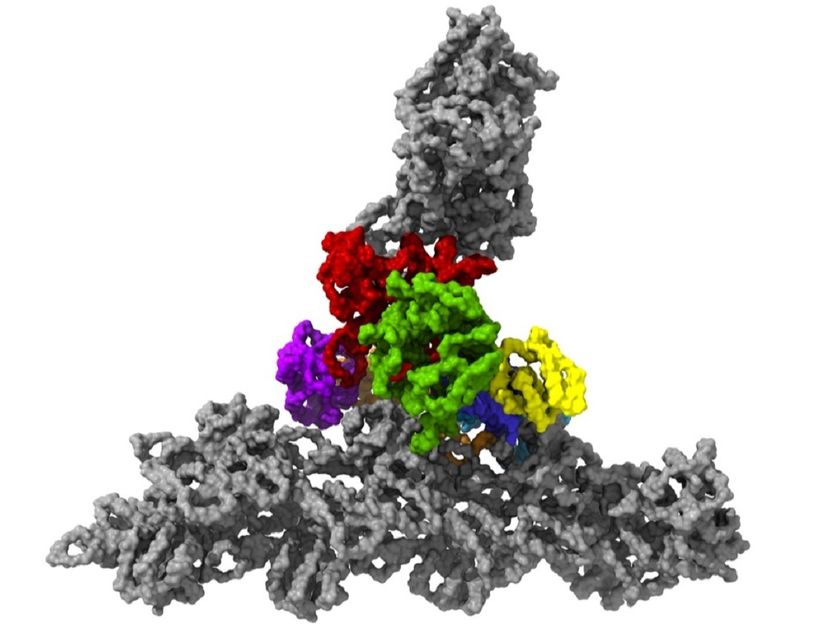
El complejo proteico Arp2/3 con sus siete subunidades (coloreado) mientras se une a los filamentos de actina (gris).
Florian Fäßler / IST Austria
Las células de nuestro cuerpo están en movimiento. Algunas migran de A a B para curar heridas o combatir patógenos. Lo hacen con la ayuda de pequeños "pies" en el borde delantero de las células migratorias, la llamada lamelipodia. Estas delgadas extensiones son empujadas hacia adelante y se unen a la superficie mientras que el resto de la célula es arrastrada. Dentro de estos pies hay una densa red de hilos proteicos entrelazados, llamados filamentos de actina, que forman el citoesqueleto de la célula. Hasta ahora no estaba claro cómo el complejo Arp2/3, un conjunto de siete proteínas centrales para la motilidad celular, brota de nuevos filamentos de actina de los ya existentes y así genera redes densas y ramificadas que proporcionan las fuerzas protrusivas necesarias a la célula.
Elecciones difíciles
Hasta ahora, los científicos tenían que decidir cuándo querían analizar la estructura del complejo Arp2/3: Una opción era estudiarlo de forma aislada, donde el complejo proteínico está en una conformación inactiva y por lo tanto no permite comprender cómo se forma la red. Sin embargo, para activarse completamente, el complejo Arp2/3 necesita estar unido a los filamentos de actina. Esto requiere el uso de un método llamado tomografía de electrones, lo que conlleva el costo de una resolución considerablemente menor. "Los datos anteriores de la tomografía electrónica de los complejos Arp2/3 unidos a filamentos de actina en un entorno de tubos de ensayo eran demasiado imprecisos, lo que hacía imposible saber sin ambigüedad dónde debían estar situados los elementos individuales del complejo", explica Florian Fäßler, un postdoctorado del grupo del profesor Florian Schur de IST Austria.
Durante más de dos años, ha estado buscando una manera de representar el complejo de proteínas en su entorno natural de tal manera que las estructuras individuales puedan ser analizadas con precisión. Ahora ha tenido éxito. Él imaginó el complejo dentro de la lamelipodia de las células de los ratones en su conformación activa de unión a la actina. "Nos dijimos a nosotros mismos: Bien, vamos a entrar en la célula, donde el entorno es mucho más intrincado porque no sólo está el complejo de proteínas y los filamentos de actina, sino también todo tipo de otras cosas. Pero esta era la única manera en que podíamos mantener esta red de tal manera que pudiéramos determinar su estructura", dice el biólogo molecular Florian Schur.
Células congeladas por choque
Esto fue posible gracias a temperaturas de 196 grados centígrados bajo cero. En milisegundos, los investigadores congelaron las muestras, demasiado rápido para permitir la formación de cristales de hielo que habrían destruido las finas estructuras de la célula. Luego utilizaron uno de los más poderosos microscopios de crioelectrón disponibles, y el único de su tipo en Austria, para tomar imágenes de las células desde diferentes ángulos utilizando la tomografía de crioelectrón. Haciendo esto, el equipo recogió suficientes datos para la reconstrucción en 3D de más de 10.000 complejos Arp2/3 en su estado activo. Combinado con un avanzado procesamiento de imágenes, generaron un modelo 3D del complejo Arp2/3 con una resolución de menos de un nanómetro. Para comparar: el cabello humano tiene un grosor de unos 50.000 nanómetros. "Ahora somos capaces de describir con relativa precisión la estructura del complejo de proteínas y sus subunidades y cómo forman la red de filamentos de actina dentro del lamelipodio de las células previamente vivas", dice Florian Fäßler. "Hace cinco años, probablemente nadie hubiera pensado que esto podría hacerse", añade Schur.
Hasta el límite
Debido a la avanzada metodología, el equipo pudo refutar un modelo anterior que había asumido conexiones de área mucho más grande entre el complejo Arp2/3 y los filamentos de actina. Sin embargo, los científicos confirmaron otros aspectos de cómo este complejo se regula y forma nuevos filamentos de actina. Con este conocimiento, otros científicos pueden ahora comprender mejor la regulación y la actividad de este importante complejo proteico en sus múltiples funciones más allá de la motilidad celular y el desarrollo de enfermedades. "Lo que hemos hecho es ir lo más lejos posible con muestras tan complejas en términos de metodología y resolución. Con la resolución actual, hemos obtenido nuevos conocimientos biológicos, pero también ha sido un avance metodológico para demostrar: Es posible", dice Schur con entusiasmo. Florian Fäßler ahora quiere mejorar aún más el método para visualizar otras proteínas y explorar hasta qué punto el método nos permite ver el interior de una célula. "Apenas estamos comenzando a realizar todo el potencial de la tomografía crioelectrónica", dice Schur.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.