Cómo las nanoesferas inteligentes y ultrafinas van en busca de proteínas
Producción más rápida y sencilla de imágenes de alta resolución, tridimensionales de microscopía electrónica de biomoléculas
Un equipo interdisciplinario de Frankfurt y Jena ha desarrollado una especie de cebo con el que pescar complejos de proteínas a partir de mezclas. Gracias a este "cebo", la proteína deseada está disponible mucho más rápido para su posterior examen en el microscopio electrónico. El equipo de investigación ha bautizado esta innovadora capa de carbono molecular ultrafino como la "nano lámina inteligente". Con la ayuda de este nuevo desarrollo, se pueden entender mejor las enfermedades y su tratamiento con medicamentos, por ejemplo.
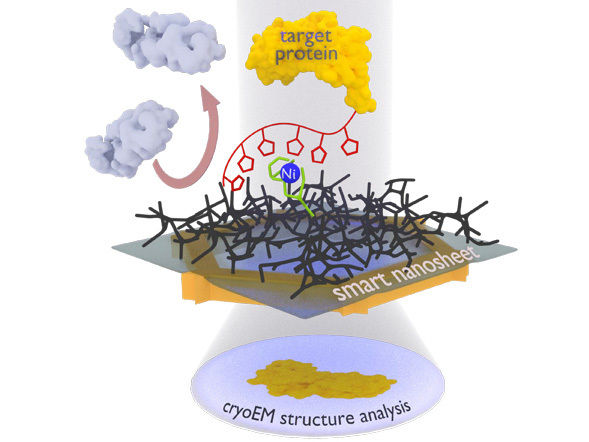
El nuevo proceso de nanosheet: El complejo de proteínas a examinar (amarillo) se une a la nanoescala inteligente a través de un complejo de níquel con la ayuda de un marcador (cadena roja con pentágonos). Las proteínas no deseadas (gris) son repelidas por el hidrogel (rejilla negra). Después de congelar toda la estructura, incluyendo una fina película de agua, ésta puede ser irradiada con electrones para obtener imágenes de las proteínas unidas, a partir de las cuales un ordenador puede calcular la estructura tridimensional de la proteína.
"Con nuestro proceso, nuevos tipos de proteínas pueden ser aislados de las mezclas y caracterizados en una semana", explica Daniel Rhinow del Instituto Max Planck de Biofísica en Frankfurt. "Hasta la fecha, sólo el aislamiento de las proteínas formaba parte de un doctorado que duraba varios años." Junto con Andreas Terfort (Universidad de Goethe) y Andrey Turchanin (Universidad Friedrich Schiller de Jena), hace unos años surgió la idea de extraer las proteínas deseadas directamente de las mezclas equipando una nano lámina con sitios de reconocimiento en los que se enlaza la proteína objetivo. Los investigadores han logrado ahora que las proteínas estén directamente disponibles para su examen mediante crio-microscopía electrónica a través de una "nano hoja inteligente".
La crio-microscopía electrónica se basa en la congelación por choque de una muestra a temperaturas inferiores a -150 °C. En este proceso, la proteína mantiene su estructura, no se necesitan agentes fijadores y colorantes que interfieran, y los electrones pueden irradiar fácilmente el objeto congelado. El resultado son imágenes tridimensionales de alta resolución de las estructuras más diminutas, por ejemplo de virus y ADN, casi a la escala de un átomo de hidrógeno.
En la preparación, las proteínas se congelan por choque en una capa extremadamente fina de agua en una diminuta rejilla metálica. Anteriormente, las muestras debían limpiarse mediante un complejo procedimiento -que a menudo implicaba una gran pérdida de material- antes de ser examinadas en un microscopio electrónico. El procedimiento de microscopía electrónica sólo tiene éxito si sólo un tipo de proteína se une a la capa de agua.
El grupo de investigación dirigido por Turchanin utiliza ahora nanoplacas de sólo un nanómetro de grosor, compuestas por una monocapa molecular reticulada y autoensamblada. El grupo de Terfort recubre esta nano lámina con un agente gelificante como base para la fina película de agua necesaria para la congelación. Los investigadores le añaden entonces sitios de reconocimiento (un grupo especial de ácido nitrilotriacético con iones de níquel). El equipo dirigido por Rhinow utiliza las "nanoesquemas inteligentes" tratadas de esta manera para obtener proteínas de pescado de una mezcla. Éstas fueron marcadas de antemano con una cadena de histidina con la que se unen a los sitios de reconocimiento; todas las demás partículas que interfieren pueden ser enjuagadas. La nano lámina con la proteína unida puede entonces ser examinada directamente con el microscopio electrónico.
"Nuestras nanoesferas inteligentes son particularmente eficientes porque la capa de hidrogel estabiliza la fina película de agua requerida y al mismo tiempo suprime la unión no específica de las partículas de interferencia", explica Julian Scherr de la Universidad de Goethe. "De esta manera, la biología estructural molecular puede ahora examinar las estructuras y funciones de las proteínas mucho más rápido." Los conocimientos adquiridos pueden utilizarse, por ejemplo, para comprender mejor las enfermedades y su tratamiento con medicamentos.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.