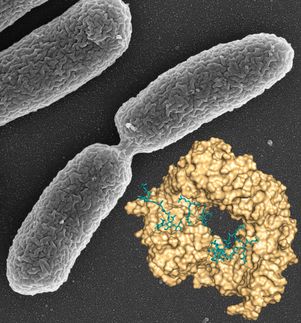
Los ojos de los rayos X se adentran más en el patógeno mortal
La tularemia es una enfermedad rara pero a menudo letal. Es causada por uno de los patógenos más agresivos de la tierra, la bacteria Francisella tularensis. El microbio, transportado por una variedad de animales e insectos, es capaz de entrar y atacar el cuerpo a través de una serie de vías, dando lugar a diferentes constelaciones de síntomas y grados de gravedad.
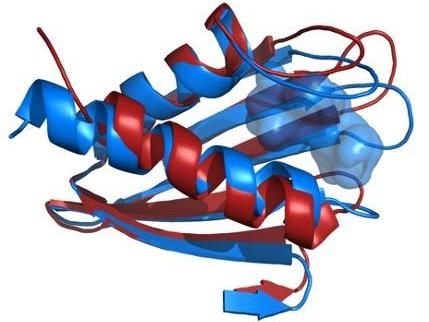
La comparación de las estructuras de la espina dorsal de la proteína Flpp3 derivadas de un láser de electrones libres de rayos X (rojo) y de la RMN (azul) revela una cavidad interna que es exclusiva de la estructura de la RMN y por lo tanto sugiere la existencia de estructuras proteínicas intermedias.
James Zook
La tularemia sigue sin entenderse bien y no existe una vacuna segura y efectiva para la enfermedad. La extrema letalidad de F. tularensis y su potencial para ser aerosolizada también la han convertido en un candidato a arma biológica, lo que aumenta la urgencia de comprender la enfermedad y desarrollar tratamientos eficaces.
En un nuevo estudio, los investigadores del Centro de Biodiseño para el Descubrimiento Estructural Aplicado examinan una proteína de membrana clave responsable de la prodigiosa capacidad de la bacteria para infectar el cuerpo y causar enfermedades. Este factor de virulencia, conocido como Flpp3, se examina con un detalle sin precedentes con la ayuda de un láser de electrones libres de rayos X o XFEL, un masivo y poderoso acelerador de rayos X ubicado en el Laboratorio Nacional de Aceleradores SLAC, en Stanford.
La tecnología del XFEL utiliza destellos brillantes y extremadamente cortos de rayos X para sondear muestras cristalizadas de Flpp3, revelando la estructura detallada de la proteína como nunca antes. Comparando la información estructural reunida por los experimentos del XFEL con el análisis estructural previo mediante RMN, los investigadores han desarrollado un modelo más completo de la forma elaborada de Flpp3. (Estudios previos han demostrado que cuando se desactiva la codificación de un gen para el Flpp3, los efectos del patógeno de F. tularensis disminuyen significativamente).
Los científicos esperan utilizar eventualmente esta información para desarrollar drogas específicas capaces de desactivar las propiedades de virulencia de la proteína y proteger contra la tularemia. Los avances en el conocimiento también podrían ayudar a los científicos a desarrollar una vacuna eficaz contra la enfermedad en el futuro. Actualmente, sólo existen vacunas vivas atenuadas para la tularemia, y los riesgos de infección e inmunidad insuficiente asociados a este enfoque han impedido el uso de tales vacunas en los Estados Unidos.
El investigador de biodiseño Dr. James Zook junto con los profesores Petra Fromme y Abhishek Singharoy del Centro de Biodiseño para el Descubrimiento Estructural Aplicado dirigieron el nuevo estudio. Se le unen colegas internacionales, incluyendo investigadores de DESY, SLAC, AstraZeneca, el Laboratorio Europeo de Biología Molecular en Grenoble, Francia, entre otros.
Petra Fromme, directora del Centro para el Descubrimiento Estructural Aplicado explica la importancia de los resultados: "Este estudio combina, por primera vez, las técnicas más avanzadas de XFEL con la RMN y el modelado molecular para desentrañar el gran espacio conformacional del Flpp3. El estudio desentraña diferentes conformaciones de esta importante proteína para la virulencia de la bacteria en la estructura del XFEL y la RMN, mostrando así la naturaleza altamente dinámica del Flpp3. Este estudio es tan emocionante que muestra que conformaciones muy diferentes coexisten y se convierten unas en otras bajo condiciones fisiológicas".
Visualización de la virulencia
Utilizando datos estructurales detallados de la RMN y el nuevo análisis XFEL del factor de virulencia de la tularemia, los investigadores identificaron un inhibidor potencial del Flpp3. Esta información se obtuvo de las bibliotecas virtuales disponibles que contienen estructuras de fragmentos de drogas. A continuación, un método de modelado basado en la física, conocido como dinámica molecular (MD), proporcionó información detallada sobre las fluctuaciones y los cambios de conformación de los átomos y moléculas en la proteína ligada a la virulencia, ayudando a los investigadores a obtener una lectura más precisa de la estructura y el comportamiento del Flpp3.
"Este trabajo proporciona varias estructuras de resolución atómica de un importante factor de virulencia de la bacteria que causa la tularemia", según la investigadora de Biodiseño Dra. Debra Hansen, coautora del nuevo estudio. Las configuraciones de proteínas identificadas ayudarán a los investigadores a buscar un diseño basado en la estructura de los medicamentos que podrían ser eficaces contra la esquiva enfermedad, a través de la focalización e inhibición del Flpp3.
Como explica el Dr. Abhishek Singharoy, coautor e investigador de biodiseño, el estudio es digno de mención por estar entre las primeras investigaciones sobre la flexibilidad conformacional de las proteínas descubiertas mediante cristalografía de rayos X de femtosegundo en serie y RMN, y confirmadas mediante simulaciones de dinámica molecular (DM).
Los hallazgos del grupo aparecen en el número actual de la revista Structure de Cell Press.
Amenaza persistente
La tularemia, también conocida como fiebre de los conejos, es una rara enfermedad infecciosa, que suele atacar los ojos, la piel, los ganglios linfáticos y los pulmones tras la infección por la bacteria F. tularensis. La enfermedad es endémica en América del Norte, así como en muchas partes de Europa y Asia, aunque los casos de tularemia son poco comunes y los brotes en toda regla tienden a restringirse a regiones con malas condiciones sanitarias e inaccesibilidad a la atención sanitaria moderna.
La tularemia afecta principalmente a los mamíferos, en particular a los roedores, conejos y liebres, aunque a veces también infecta a las aves, las ovejas y los animales domésticos, incluidos los perros, los gatos y los hámsteres.
La enfermedad puede propagarse a los seres humanos a través de las picaduras de insectos y la exposición directa a un animal infectado. La enfermedad es extremadamente contagiosa. Sólo 10 células bacterianas pueden ser mortales y una sola bacteria puede ser suficiente para causar la infección. El organismo puede vivir durante semanas en el suelo, el agua y los animales muertos.
La tularemia puede tratarse eficazmente si se detecta a tiempo, aunque el régimen de tratamiento puede ser largo y complejo. La mayoría de los infectados con F. tularensis muestran síntomas en un plazo de tres a cinco días, aunque puede tardar hasta dos semanas.
La enfermedad existe en una variedad de formas con diferentes síntomas, dependiendo de cómo y dónde la bacteria entra en el cuerpo. Entre ellas se incluye la tularemia ulceroglandular, la forma más común, que produce úlceras en la piel en el lugar de la infección, glándulas linfáticas hinchadas y dolorosas, fiebre, escalofríos, dolor de cabeza y agotamiento.
Otras formas incluyen la tularemia glandular, oculoglandular, orofaríngea, neumónica y tifoidea. Si no se trata, pueden surgir diversas complicaciones graves de la enfermedad, como meningitis, inflamación de los pulmones, irritación alrededor del corazón e infección de los huesos.
El método de los cristales
En el presente estudio, se utiliza una técnica conocida como cristalografía de rayos X de femtosegundo en serie para sondear la estructura de la proteína Flpp3. Aquí, breves y brillantes estallidos de rayos X, aproximadamente mil millones de veces más brillantes que los rayos X convencionales, golpean un chorro de cristales "volando" a través del haz de rayos X. La intensa explosión de rayos X destruye los cristales pero antes de hacerlo, crea un patrón de difracción en una pantalla. Los pulsos de rayos X son ultracortos, con una duración de sólo 40 femtosegundos, que superan el daño de los rayos X, lo que permite recoger datos a temperatura ambiente en condiciones casi fisiológicas. (1 fs = 10-15 segundos o una cuatrillonésima de segundo).
El ensamblaje de muchas de estas tomas de rayos X con la ayuda de computadoras permite el ensamblaje de una detallada estructura tridimensional de la proteína en estudio. El llamado método de difracción antes de la destrucción fue iniciado por Henry Chapman en el Deutsches Elektronen-Synchrotron (DESY) con el equipo de ASU bajo la dirección de John Spence y Petra Fromme y sus colaboradores.
Los investigadores combinaron los nuevos datos estructurales del XFEL con sus anteriores estudios de RMN del Flpp3, observando dos estados distintos de la proteína. Las simulaciones MD revelaron una estructura de cavidad interna que es transitoria, sugiriendo que el Flpp3 sufre un sutil cambio conformacional.
Este enfoque abre la puerta al desarrollo de drogas dirigidas a reducir la letalidad de la tularemia y muestra el poder de las tecnologías combinadas para desentrañar los detalles de la estructura y la dinámica de las proteínas.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.