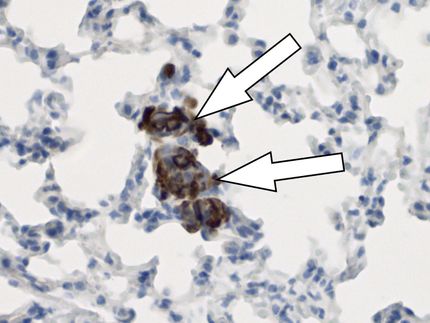
Un derrame cerebral: Los macrófagos migran desde la sangre
El cambio molecular en las células madre de la médula ósea ayuda a la investigación de los procesos inflamatorios en el cerebro
Los macrófagos forman parte del sistema inmunológico innato y son esenciales para el desarrollo y la función del cerebro. Utilizando un método novedoso, científicos del Hospital Universitario de Jena, la Universidad de Bonn y el Memorial Sloan Kettering Cancer Center de Nueva York (EE.UU.) lograron visualizar macrófagos que se formaron en la médula ósea. En estudios realizados en ratones, esta tecnología permitió a los investigadores observar que poco después de un derrame cerebral, numerosos macrófagos que habían migrado de la sangre comienzan a atacar el tejido cerebral sano muerto y adyacente.
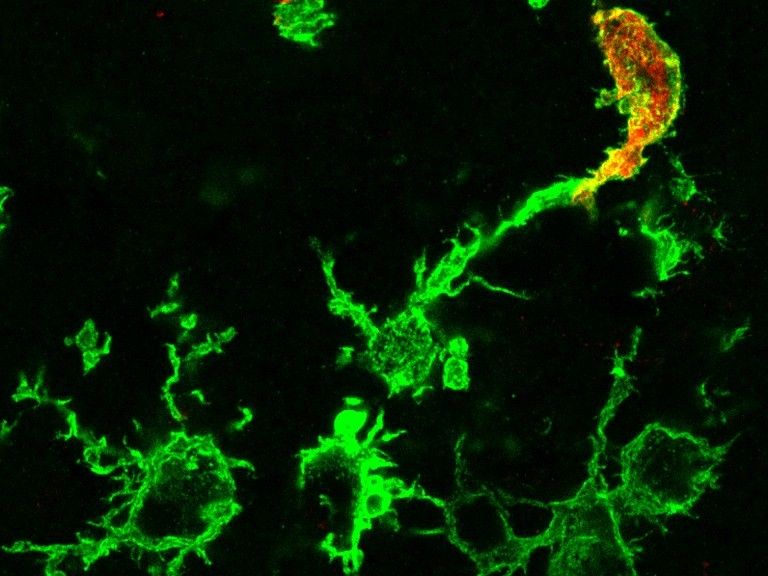
Imagen microscópica de macrófagos manchados de verde después de un derrame cerebral: La célula manchada de rojo adicional (arriba a la derecha) se origina en la médula ósea, las células verdes puras son microglia residente.
(c) AG Stumm/UKJ
En el griego antiguo, el término macrófago significa algo así como "gran comilón". Estas células son componentes de nuestro sistema inmunológico innato que están presentes en todos los tejidos de nuestro cuerpo. En el cerebro, estas células inmunes residentes se llaman microglia y juegan un papel esencial en el desarrollo y funcionamiento normal del cerebro. Durante los procesos inflamatorios, por ejemplo después de un derrame cerebral, infecciones cerebrales, esclerosis múltiple o enfermedad de Alzheimer, entran en juego otros macrófagos, que son reclutados de la médula ósea. En lo que respecta a las enfermedades cerebrales, ¿importa el hecho de que los macrófagos residan en el cerebro o hayan emigrado a él? Esta cuestión ha quedado sin resolver hasta ahora porque los científicos no han podido diferenciar entre los dos tipos de células utilizando métodos convencionales.
Aquí es precisamente donde entra en juego la investigación del grupo de trabajo dirigido por el Prof. Dr. Ralf Stumm del Hospital Universitario de Jena y sus socios Prof. Dr. Elvira Mass de la Universidad de Bonn y el Prof. Dr. Frederic Geissmann del Memorial Sloan Kettering Cancer Center de Nueva York (EE.UU.). El equipo estudió ratones en los que la información genética para un cambio molecular se introdujo en un gen llamado Cxcr4. Si este interruptor se activa con un agente especial, las células madre de la médula ósea, de las cuales se originan todas las células inmunes que circulan por la sangre, producen una proteína fluorescente de color.
Los microglia en el cerebro no se iluminan
"El truco de nuestro modelo es que esta característica se transfiere a las células hijas que circulan por la sangre, mientras que las microglías residentes en el cerebro no están marcadas", explica el farmacólogo Stumm. Por lo tanto, las células inmunes inmigradas pueden distinguirse fácilmente de la microglia por su color. Los investigadores pudieron demostrar que durante una vida saludable de los ratones, virtualmente ningún macrófago generado por las células madre de la médula ósea se asienta en el cerebro. Esto complementa los hallazgos anteriores de los profesores Geissmann y Mass de que los macrófagos localizados en los tejidos se desarrollan muy temprano durante el desarrollo embrionario, colonizan todo el embrión y desde entonces se mantienen a sí mismos a través de la división celular.
Con la ayuda de su estudio modelo en ratones, los investigadores han descubierto ahora que poco después de un derrame cerebral, numerosos macrófagos que habían emigrado de la sangre comienzan a atacar el tejido cerebral sano muerto y adyacente. Contrariamente a las suposiciones anteriores, los forasteros se retiraron completamente del tejido cerebral sano en los días siguientes y sólo se encontraron en el tejido cerebral muerto.
Los investigadores inactivaron la función del gen Cxcr4
En un siguiente paso, los investigadores inactivaron la función del gen Cxcr4, dejando intacto el interruptor molecular que les ayuda a detectar las células inmunes inmigradas. "Nos interesó el Cxcr4 porque esta proteína actúa como una antena, es decir, como un receptor, de una sustancia mensajera que se cree que está involucrada en los procesos inflamatorios del cerebro", dice el Prof. Stumm. Los investigadores encontraron que un derrame cerebral inicialmente atrajo menos macrófagos al cerebro cuando faltaba la función Cxcr4. En los días siguientes, los macrófagos que habían migrado al cerebro migraron sólo de forma incompleta al tejido cerebral muerto. Algunos permanecieron en el tejido cerebral sano durante demasiado tiempo e impidieron que la microglia residente se asentara.
"Además, numerosos genes necesarios para una respuesta inmunológica protectora no se activaron en los macrófagos inmigrados, mientras que los genes promotores de la inflamación se sobreexpresaron en los macrófagos residentes", dice el profesor Mass, que es miembro del Grupo de Excelencia en InmunoSensación de la Universidad de Bonn. Además, la ausencia del receptor Cxcr4 en ratones con apoplejía resultó en un aumento del daño tisular y en un empeoramiento del estado general de los ratones.
El cambio genético es una herramienta universal
En general, los investigadores ven dos hitos alcanzados: Su interruptor genético es una herramienta universal que permite a los científicos investigar mejor la función de las células inmunes originadas en la médula ósea. Además, muestran que el receptor Cxcr4 es parte de una respuesta inmune con la que los macrófagos que se originan en la médula ósea protegen el cerebro dañado. "Cuanto mejor entendamos la activación espacial y temporal de la molécula Cxcr4 durante un accidente cerebrovascular, mejor podremos tratar a los pacientes con medicamentos inhibidores de Cxcr4 en el futuro", dice el Prof. Stumm.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
Yves Werner, Elvira Mass, Praveen Ashok Kumar, Thomas Ulas, Kristian Händler, Arik Horne, Kathrin Klee, Amelie Lupp, Dagmar Schütz, Friederike Saaber, Christoph Redecker, Joachim L. Schultze, Frederic Geissmann & Ralf Stumm; "Cxcr4 distinguishes HSC-derived monocytes from microglia and reveals monocyte immune responses to experimental stroke"; Nature Neuroscience; 2020