Observar las moléculas complejas en el trabajo
Un nuevo método de espectroscopia infrarroja desarrollado en BESSY II permite por primera vez observar y analizar con una sola medida los mecanismos de reacción muy rápidos e irreversibles de las moléculas. Anteriormente, miles de estas reacciones han tenido que ser ejecutadas y medidas para este propósito. El equipo de investigación ha utilizado ahora el nuevo dispositivo para investigar cómo las moléculas de rodopsina cambian después de ser activadas por la luz - un proceso que es la base de cómo vemos.
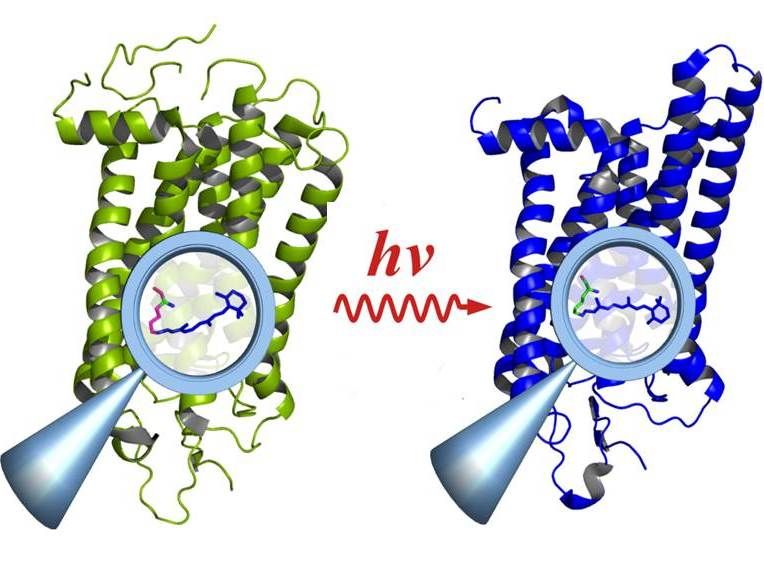
La rodopsina antes (izquierda) y después de la activación por la luz (derecha): La activación provoca cambios en los grupos funcionales dentro de la molécula (lupa), que afectan a toda la molécula.
© E. Ritter/HZB
La espectroscopia infrarroja con resolución temporal en el rango de submilisegundos es un método importante para estudiar la relación entre la función y la estructura en las moléculas biológicas. Sin embargo, el método sólo funciona si la reacción puede repetirse miles de veces. Sin embargo, no es el caso de un gran número de procesos biológicos, porque a menudo se basan en reacciones muy rápidas e irreversibles, por ejemplo en la visión. Los cuantos de luz individuales que entran en los bastoncillos de la retina activan las moléculas de proteína de rodopsina, que luego se descomponen después de cumplir su función de fototransducción.
Espectrómetro Féry para mediciones de disparo único
Ahora, un equipo encabezado por el Dr. Ulrich Schade (HZB) y el Dr. Eglof Ritter (Humboldt-Universität zu Berlin) en la línea de haz IRIS de BESSY II ha desarrollado un nuevo instrumento que puede detectar este tipo de reacciones muy rápidas y/o irreversibles con una sola medición. La resolución de tiempo es de unos pocos microsegundos. El instrumento, un espectrómetro Féry, utiliza un detector de alta sensibilidad conocido como conjunto de detectores de plano focal y una óptica especial para aprovechar al máximo la brillante radiación infrarroja de la fuente de sincrotrón BESSY II. El equipo utilizó este dispositivo para observar por primera vez la activación de la rodopsina en condiciones casi in vivo.
La rodopsina como caso modelo
"Utilizamos la rodopsina porque se descompone irreversiblemente después de ser excitada por la luz y por lo tanto es una verdadera prueba de fuego para el sistema", explica Ritter, primer autor del estudio. La rodopsina es una molécula de proteína que actúa como receptor y es el pigmento de la visión que se encuentra en los bastoncillos de la retina del ojo. Incluso los fotones individuales pueden activar la rodopsina - permitiendo al ojo percibir niveles extremadamente bajos de luz. Además, la rodopsina es el elemento común en una clase de receptores con cientos de miembros que son responsables del olfato, el gusto, la sensación de presión, la recepción de hormonas, etc. - todos los cuales funcionan de manera similar.
El equipo también estudió por primera vez otra proteína excitante en el rango infrarrojo: la actinorodopsina. Esta molécula es capaz de convertir la energía de la luz en una corriente eléctrica, una propiedad que algunas bacterias utilizan para generar energía electroquímica para su metabolismo.
"El nuevo método nos permite investigar los mecanismos de reacción molecular de todos los procesos irreversibles (o de los procesos cíclicos lentos), como los del campo de la conversión y el almacenamiento de energía, por ejemplo", subrayó Schade, que dirige el equipo del IRIS.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.