Activación de los receptores de opiáceos descubiertos
Junto con colegas de Shanghai, Bruselas, Canadá y los Estados Unidos, investigadores de la Universidad de Bonn han descubierto el mecanismo de unión de un importante receptor del dolor. Los resultados facilitan el desarrollo de nuevas sustancias activas. Los opiáceos que se usan hoy en día para tratar el dolor intenso pueden ser adictivos y a veces tienen efectos secundarios potencialmente mortales.
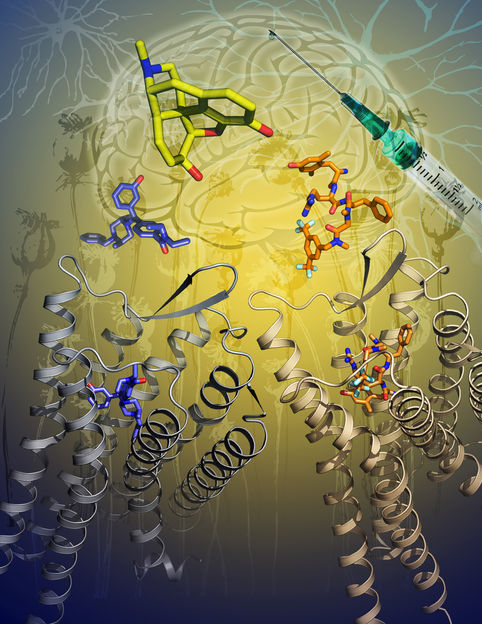
La ilustración muestra las dos nuevas estructuras cristalinas del receptor delta-opioide (DOP) en complejo con dos moléculas activadoras (azul y naranja). La morfina, un potente analgésico, se muestra en amarillo.
© Graphic: Katya Kadyshevskaya/University of Southern California
Los opiáceos se encuentran entre los analgésicos más eficaces disponibles en la actualidad. Entre ellas figuran, por ejemplo, la morfina o la oxicodona, que se ha recetado con mucha negligencia en los Estados Unidos. Con graves consecuencias: Cientos de miles de pacientes se han vuelto adictos; muchos de ellos terminaron más tarde en drogas como la heroína o el fentanilo.
La oxicodona se une a los llamados receptores de opioides en el cuerpo. Hay tres tipos diferentes: MOP, DOP y KOP. Los analgésicos disponibles hasta la fecha activan principalmente la MOP (también llamada receptor µ-opioide). Sin embargo, la MOP estimulante no sólo puede ser adictiva, sino que también puede tener efectos secundarios potencialmente mortales. La más grave es la parálisis respiratoria, por lo que la causa más común de muerte después del consumo de heroína es el paro respiratorio.
"Los medicamentos que se unen selectivamente al receptor DOP probablemente no tengan estos efectos secundarios dramáticos", espera la Prof. Dra. Christa Müller del Instituto Farmacéutico de la Universidad de Bonn. El énfasis está en lo"selectivo": Los receptores de opioides son tan similares que muchos medicamentos activan las tres formas. Para encontrar sustancias que sólo se adhieren al receptor DOP, es necesario saber exactamente qué ocurre durante el proceso de unión.
Estructura espacial visible hasta el nivel atómico
El estudio actual puede ahora responder a esta pregunta. "Hemos activado el receptor DOP con dos moléculas diferentes, purificando el complejo y luego elucidando su estructura mediante rayos X", explica Tobias Claff, quien llevó a cabo la mayoría de los experimentos. Para ello, el complejo de receptor y sustancia activa se transforma en un estado cristalino. La red cristalina desvía la luz de rayos X de una manera característica. La distribución de la intensidad de la radiación difractada puede, por tanto, utilizarse para deducir la estructura espacial del complejo, hasta la disposición de cada átomo individual.
"Esto nos permitió mostrar qué partes del receptor son responsables de la unión de los medicamentos", dice Claff. "Este conocimiento debería permitir el desarrollo de nuevas sustancias que sólo activan la DOP". Existe un gran interés en estos fármacos, sobre todo porque, a diferencia de su homólogo de la MOP, el receptor DOP no es principalmente eficaz contra el dolor agudo, sino contra el dolor crónico. Esto es actualmente muy difícil de tratar.
La cristalografía de rayos X no es una técnica nueva. Sin embargo, la estructura de los receptores acoplados a la proteína G (incluidos los receptores de opiáceos) no pudo resolverse hasta hace poco. Estas proteínas de membrana están localizadas en la membrana delgada, similar a la grasa que rodea el contenido de la célula como una especie de bolsa. Su solubilidad en grasa significa que deben ser estabilizados con un gran esfuerzo durante la cristalización. De lo contrario, se desnaturalizan y, como resultado, cambian su estructura espacial. "Sólo unos pocos laboratorios en el mundo son capaces de tratar estos problemas", enfatiza Christa Müller.
En la Universidad de Bonn, los aspirantes a farmacéuticos pueden ir al extranjero durante su programa de maestría o examen estatal. El Instituto cuenta con una amplia red de socios de cooperación, hecho que se valora muy positivamente en el Ranking de Universidades CHE. Tobias Claff aprovechó esta oportunidad: "Pasé un año de mi maestría en el instituto iHuman de la Universidad de ShanghaiTech", explica. "En los últimos años, la cristalografía de las proteínas de la membrana ha sido crucialmente avanzada allí." Claff aprendió el complejo método en Shangai, un saber hacer que ahora también beneficia a su universidad de origen, a la que entretanto ha regresado.
El profesor Müller subraya que no es frecuente que un estudiante de máster aborde un problema tan complejo. "Este éxito es un logro extraordinario", dice. "También demuestra la excelente posición de la Escuela de Farmacia con su programa de intercambio internacional."
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
Tobias Claff, Jing Yu, Véronique Blais, Nilkanth Patel, Charlotte Martin, Lijie Wu, Gye Won Han, Brian J. Holleran, Olivier Van der Poorten, Michael A. Hanson, Philippe Sarret, Louis Gendron, Vadim Cherezov, Vsevolod Katritch, Steven Ballet, Zhi-Jie Liu, Christa E. Müller, Raymond C. Stevens; "Elucidating the active delta-opioid receptor crystal structure with peptide and small molecule agonists"; Science Advances; 2019