Enzimas'respiratorias' en movimiento rápido
Investigadores observan el trabajo de una enzima con un detalle sin precedentes
Investigadores del Departamento de Dinámica Atómica Resuelta del Instituto Max Planck para la Estructura y Dinámica de la Materia (MPSD) en el Centro para la Ciencia del Láser de Electrones Libres en Hamburgo, la Universidad de Potsdam (ambas en Alemania) y la Universidad de Toronto (Canadá) han montado una película detallada de lapso de tiempo que revela todos los pasos principales durante el ciclo catalítico de una enzima. Sus hallazgos acaban de ser publicados en Science. Sorprendentemente, la comunicación entre las unidades de proteína se realiza a través de una red de agua similar a una cadena telefónica. Esta comunicación está alineada con un movimiento de"respiración", es decir, la expansión y contracción de la proteína. Esta secuencia de estructuras en un lapso de tiempo revela los movimientos dinámicos como un elemento fundamental en los fundamentos moleculares de la biología.
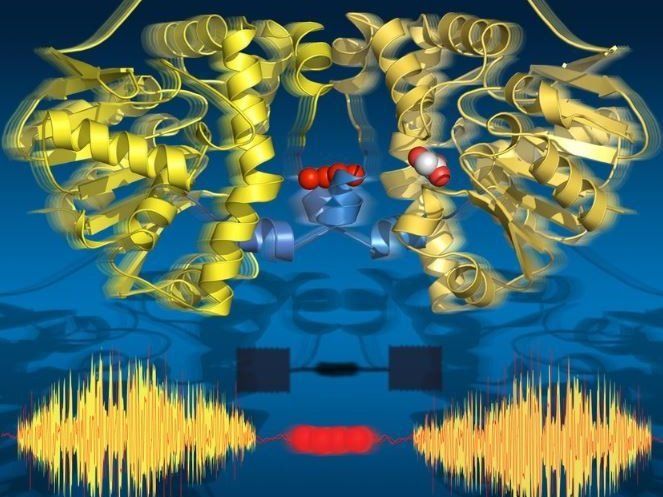
La cristalografía de sincrotrón en serie resuelta en el tiempo captura todos los estados clave de la catálisis y revela la vía de transmisión alostérica entre las dos subunidades de la enzima.
Toda la vida es dinámica y también lo son sus componentes moleculares. Los movimientos y cambios estructurales de las biomoléculas son fundamentales para sus funciones. Sin embargo, comprender estos movimientos dinámicos a nivel molecular es un desafío formidable. ¿Cómo puede una proteína acelerar una reacción química, que tardaría años en producirse sin ayuda?
Para ello, los investigadores recurrieron a una enzima que divide el enlace simple más fuerte de la química orgánica: el enlace C-F. Los carbones fluorados pueden encontrarse en materiales como el teflón o GoreTex y en muchos productos farmacéuticos y pesticidas. Los compuestos fluorados tienen una influencia especial en el cambio climático, superando la eficacia del CO2 en varios órdenes de magnitud. Por lo tanto, la capacidad de comprender mejor y, en última instancia, controlar el volumen de negocios de los bonos C-F es de particular interés para el cambio climático y la biorremediación.
Los investigadores utilizaron la cristalografía de rayos X con resolución temporal para tomar instantáneas moleculares durante la reacción de rotación de esta enzima natural a temperaturas fisiológicas. Esta película de lapso de tiempo reveló dieciocho puntos de tiempo de 30 milisegundos a 30 segundos, cubriendo todos los estados catalíticos clave que conducen a la ruptura del vínculo C-F. Sorprendentemente, la película también muestra que la enzima 'respira' durante la rotación, es decir, se expande y contrae alineada con los sub-pasos catalíticos.
Sorprendentemente, las dos mitades de la enzima se comunican entre sí a través de una cadena de moléculas de agua que conecta ambas mitades. Esta red de agua permite que las dos mitades"hablen" entre sí y compartan información sobre su estado catalítico. Esto es crucial para la función de la enzima, ya que sólo la mitad de la enzima puede estar activa en un momento dado.
Estos cambios dinámicos han demostrado ser cruciales para la función de la enzima. Los investigadores esperan que muchos otros sistemas exploten mecanismos similares para sus actividades.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.