En el centro activo de la conversión de dióxido de carbono
Los científicos revelan las características de las eficientes enzimas carboxilásicas
Para superar la crisis climática se requieren dos medidas: La reducción de las emisiones de dióxido de carbono (CO2) y la eliminación del CO2 de la atmósfera terrestre. Este último es el objetivo del grupo de investigación de Tobias Erb en el Instituto Max Planck de Microbiología Terrestre de Marburgo. Sus enfoques no sólo pretenden beneficiar la protección del clima, sino también asegurar la sostenibilidad a largo plazo: filtrar el CO2 del aire y hacerlo utilizable para la tecnología.
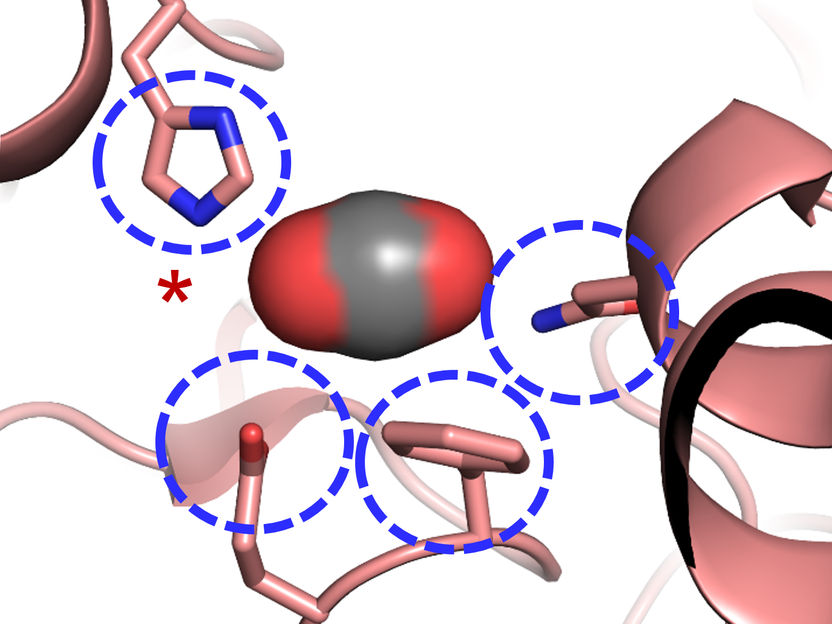
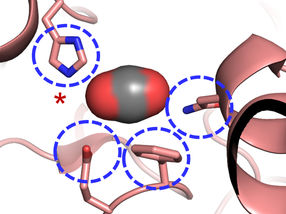
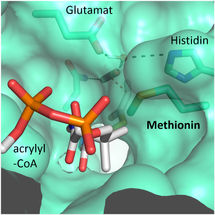
El sitio activo de la carboxilasa: Cuatro aminoácidos son importantes para la fijación del CO2 en enzimas fijadoras de CO2 altamente eficientes.
© Max-Planck-Institute for Terrestrial Microbiology/Erb
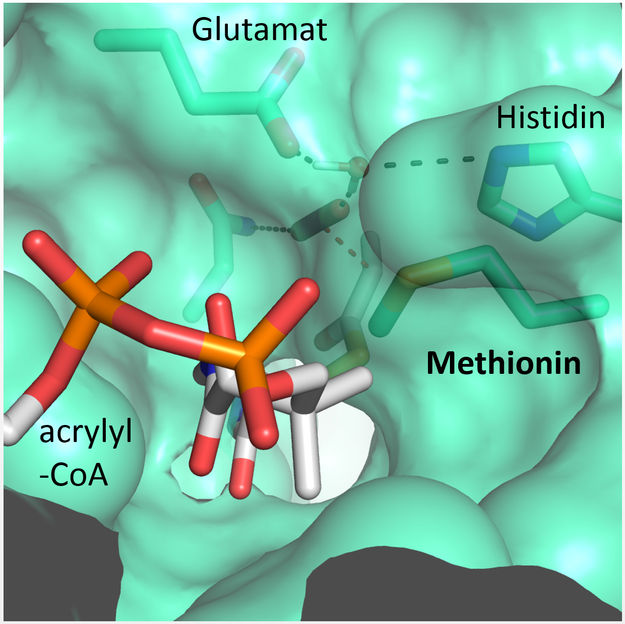
Un residuo de metionina protege el sitio activo de las moléculas de agua de la competencia.
© Max-Planck-Institute for Terrestrial Microbiology/Erb
Filtrar el CO2 eficientemente desde el aire - la naturaleza puede hacerlo a través de la fotosíntesis, convirtiendo el CO2 en biomasa. A diferencia de las tecnologías industriales, que sólo pueden utilizar el gas de forma altamente concentrada (que a su vez consume energía fósil), la fotosíntesis funciona directamente con aire ambiente que contiene sólo un 0,04% de dióxido de carbono gaseoso. Su secreto radica en las enzimas, proteínas que actúan como catalizadores para mediar reacciones químicas específicas, como la fijación del CO2. En la fotosíntesis, esta reacción es impulsada por la enzima RubisCO. Sin embargo, la eficacia de la fotosíntesis natural no es muy alta: en más de una cuarta parte de los casos, RubisCO metaboliza el oxígeno del aire, que es un fuerte competidor del CO2 en esta reacción.
Las enzimas ECR son más rápidas y precisas que RubisCo
Por lo tanto, los investigadores de Max Planck en Marburgo han optado por alternativas a RubisCO. Las enzimas Enoyl-CoA Carboxilasa/Reductase (ECRs) son mucho más eficientes que RubisCO y no cometen errores con el oxígeno. Después de muchos años de trabajo científico para entender esta capacidad, los científicos han logrado construir un proceso de funcionamiento en el tubo de ensayo que fija el CO2 mejor que la propia naturaleza. La robustez y la eficiencia energética son las cualidades que el equipo quiere otorgar a su fotosíntesis artificial. "Aprender de los mejores" es el lema: la naturaleza misma sirve de modelo para la biología molecular.
¿Cuál es la razón de la alta eficiencia de los T.P.V.? ¿Cuál es el hechizo mágico para crear un fijador de CO2 turbo? Los investigadores junior de Max Planck, Gabriele Stoffel e Iria Bernhardsgrütter, trataron esta cuestión junto con colegas de Chile y Estados Unidos. Analizaron el ECR de la bacteria Kitasatospora setae, actualmente la carboxilasa más rápida conocida. Utilizando un enfoque combinado de biología estructural, bioquímica y simulaciones por ordenador, fueron capaces de comprender por primera vez cómo la enzima se une y convierte el CO2.
Trabajo en equipo en el centro activo
"Nos sorprendió saber que sólo cuatro aminoácidos son suficientes para controlar la molécula de CO2", explica Gabriele Stoffel, becaria postdoctoral del departamento de Erb y primera autora del estudio. "Tres aminoácidos -una asparagina, un glutamato y una histidina- mantienen el CO2 en su lugar por dos lados. Otro aminoácido, una fenilalanina, protege el CO2 ligado al agua, lo que inhibiría la reacción", dice Stoffel.
Estos hallazgos abren nuevos caminos para los investigadores. "Queríamos transferir la capacidad de unir el CO2 a otras enzimas. Esto nos ofrecería muchas más posibilidades de optimizar la fotosíntesis", dice Iria Bernhardsgrütter, estudiante de doctorado en el grupo de investigación. En otro estudio, Bernhardsgrütter se centró en dos candidatos para el andamiaje de proteínas: Propionil-CoA sintasa (PCS) y Enoil-CoA reductasa Arqueológica (AER).
Mejora de la capacidad de fijación de CO2
Ambas enzimas ya eran capaces de utilizar CO2, pero sólo con una eficiencia de alrededor del cinco por ciento y con CO2 concentrado. Los modelos computacionales revelaron que esas enzimas sólo poseían algunos de los cuatro aminoácidos requeridos y que también estaban desalineados. Iria Bernhardsgrütter tuvo éxito intercambiando aminoácidos para corregir los "miscasts" en PCS. Inmediatamente, la eficiencia del CO2 aumentó a alrededor del 20 por ciento. Ahora, el segundo aspecto era el de proteger el sitio de unión del agua. Iria Bernhardsgrütter también pudo resolver este problema: otro reemplazo de aminoácidos bloqueó el acceso del agua al sitio de unión. La combinación de ambos cambios condujo a una tasa de carboxilación de casi el 95%. Experimentos similares con AER aumentaron la eficiencia de la conversión de CO2 a casi un 90%.
Este conocimiento de los requisitos exactos de las enzimas fijadoras de CO2 y su exitosa aplicación ha llevado a la investigación a un paso decisivo hacia sus altos objetivos: por un lado, ser capaz de filtrar el CO2 eficientemente de la atmósfera, por otro lado, integrar el CO2 en el uso sostenible - hacia el reciclaje de sustancias valiosas siguiendo el ejemplo de la naturaleza.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
Stoffel, G. M. M.; Saez, D. A.; DeMirci, H.; Vögeli, B.; Rao, Y.; Zarzycki, J.; Yoshikuni, Y.; Wakatsuki, S.; Vöhringer-Martinez, E.; Erb, T. J.; "Four amino acids define the CO2 binding pocket of enoyl-CoA carboxylases/reductases"; Proceedings of the National Academy of Sciences 201901471 (2019).
Bernhardsgrütter, I.; Schell, K.; Peter, D. M.; Borijan, F.; Saez, D. A.; Vöhringer-Martinez, E.; Erb, T.; "Awakening the Sleeping Carboxylase Function of Enzymes:Engineering the Natural CO2‑Binding Potential of Reductases"; Journal of the American Chemical Society 141, 9778 −9782 (2019).