Avances en la comprensión del surgimiento de las enfermedades autoinmunes
Científicos brasileños emplean una herramienta de edición en un gen clave para la eliminación de las células autoagresivas y en el control de la aparición de afecciones tales como la diabetes mellitus tipo 1
El sistema inmunológico humano falla en ocasiones en su función de reconocer tejidos y órganos como elementos propios del cuerpo, y pasa entonces a atacarlos como si fuesen extraños. A ese error de identificación se le da el nombre de autoinmunidad agresiva y desencadena enfermedades tales como el síndrome poliglandular autoinmune tipo 1 (APS-1) y la diabetes mellitus tipo 1.
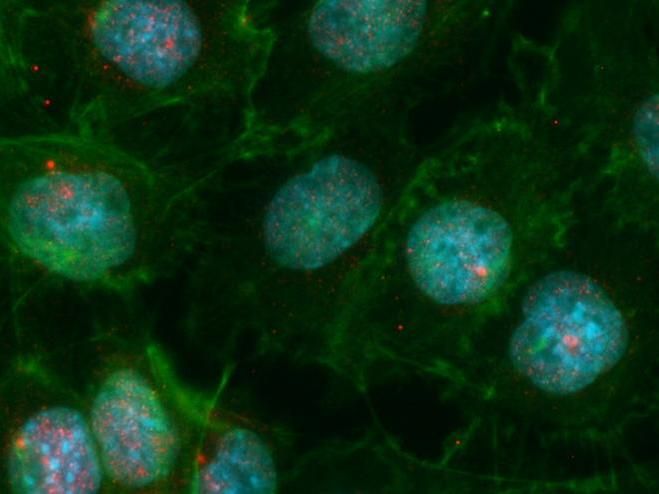
Imagen de inmunofluorescencia de células mTEC donde el núcleo celular aparece en azul y los puntos rojos corresponden a la proteÃna AIRE ed dots.
Karina F. Bombonato-Prado (FORP-USP)
En los últimos años se descubrió que dos genes que actúan en las células de la médula del timo (células mTEC), controlan la autoinmunidad agresiva: el Fezf2 (las siglas en inglés de forebrain-expressed zinc finger 2) y, fundamentalmente, el Aire (las siglas en inglés de autoimmune regulator).
Un grupo de investigadores de la Universidad de São Paulo (USP), en Brasil, en sus facultades de Medicina (FMRP) y de Odontología de Ribeirão Preto (FORP), empleó el sistema CRISPR-Cas9 -una herramienta de edición del ADN- para manipular el gen Aire con el objetivo de entender mejor cómo actúa éste en el control de enfermedades autoinmunes.
Este estudio, producto de un proyecto de investigación que contó con el apoyo de la Fundación de Apoyo a la Investigación Científica del Estado de São Paulo - FAPESP y del trabajo de maestría de Cesar Augusto Speck-Hernández, realizado en la FMRP-USP, salió publicado en la revista Frontiers in Immunology.
"Utilizamos por primera vez el CRISPR-Cas9 para 'anular' el Aire en células mTEC de ratones cultivadas in vitro [fuera del cuerpo de los animales] y para estudiar el efecto de la pérdida de función de ese gen", declaró Geraldo Aleixo Passos, docente de la FMRP y de la FORP-USP y coordinador del proyecto.
Aleixo Passos explica que las enfermedades autoinmunes son desencadenadas por autoanticuerpos (que reaccionan contra el propio cuerpo) o por los linfocitos T autoagresivos. Estas células, provenientes de los "timocitos", son "educadas" en la glándula del timo (un órgano torácico situado inmediatamente delante del corazón) para no atacar a los elementos propios del cuerpo.
Cuando esta educación falla, el timo deja escapar hacia el resto del cuerpo linfocitos T autoagresivos que pueden atacar órganos tales como la glándula suprarrenal (causando el síndrome APS-1) o el páncreas, en donde destruyen las células productoras de insulina y provocan el surgimiento de la diabetes mellitus tipo 1.
Investigadores del área de inmunología siempre asociaron la función del gen Aire con la eliminación de los timocitos autoagresivos, pues los pacientes con el síndrome APS-1, por ejemplo, presentan mutaciones en la secuencia del ADN de ese gen. Pero aún no existía una demostración cabal que validase esta asociación.
"Decidimos poner a prueba la hipótesis de que el gen Aire estaría implicado en la eliminación de los timocitos autoagresivos al controlar la adherencia física o el contacto de éstos con las células mTEC. Sin el contacto físico con las células mTEC, los timocitos autoagresivos no son eliminados", dijo Aleixo Passos.
La edición del gen
Los científicos intuyeron que si los pacientes con enfermedades autoinmunes tuvieran mutaciones en el Aire, este gen perdería la función de controlar la adherencia entre las células mTEC y los timocitos autoagresivos.
Con el fin de poner a prueba esta hipótesis, emplearon el CRISPR-Cas9 para romper el ADN del gen Aire de células mTEC de ratones y provocar mutaciones en el mismo, a los efectos de hacer posible la pérdida de su función original.
Para funcionar, un gen debe estar entero, es decir, no puede tener mutaciones deletéreas. Cuando el ADN del mismo se rompe por la acción del CRISPR-Cas9, la célula activa un sistema de emergencia de "reparación" para reunir nuevamente la cadena doble antes de que ésta se muera. Debido a que este sistema de reparación no es muy eficiente, la propia célula genera errores en la secuencia del gen blanco que resultan en una mutación, según explicó Aleixo Passos.
"El gen blanco mutante generalmente pierde su función original y esto ocasiona algún problema en la célula mutante", dijo.
Los investigadores de la USP observaron que las células mTEC Aire mutantes se mostraron menos capaces de adherirse a los timocitos cuando se las comparó con las células normales, denominadas Aire silvestres.
Al efectuar la secuenciación del transcriptoma, esto es, del conjunto completo de los ARNs mensajeros (microARNs, codificadores de proteínas) de las células mTEC Aire mutantes y de las silvestres, observaron que el gen Aire también controla microARNs codificadores de proteínas que participan en la adherencia entre células.
En un estudio anterior, realizado durante el trabajo de maestría de Nicole Pezzi, bajo la dirección de Aleixo Passos, los investigadores demostraron mediante el empleo de una técnica de silenciamiento génico llamada ARN interferente que el gen Aire controla realmente la adherencia entre las células mTEC y los timocitos.
"Estas nuevas constataciones refuerzan la tesis que indica que el gen Aire está implicado en la adherencia mTECs-timocitos, que es un proceso esencial para la eliminación de las células autoagresivas y la prevención de las enfermedades autoinmunes", dijo Aleixo Passos, científico asociado al Centro de Investigación en Enfermedades Inflamatorias (CRID), un Centro de Investigación, Innovación y Difusión (CEPID) financiado por la FAPESP.
A su juicio, la utilización de la técnica CRISPR-Cas9 abre perspectivas importantes de investigación tendientes a "editar" el genoma de las células mTEC de ratones de laboratorio, de modo tal de "mimetizar" las mutaciones del gen Aire halladas en los pacientes con enfermedades autoinmunes.
"Esto facilitará sobremanera las investigaciones sobre el efecto de las mutaciones patogénicas del gen Aire. Como los genomas del hombre y del ratón son muy parecidos en términos de secuencias de ADN [más del 80% de identidad], podremos seguir empleando el CRISPR-Cas9 en las células de ese animal para estudiar los mecanismos de la autoinmunidad agresiva que se producen en humanos y quizá, en un futuro, intentar corregirlos", dijo Aleixo Passos.