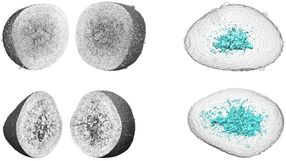
Schlüsselprozesse bei Lungenkrebs aufgeklärt
Bei etwa 90 Prozent aller Krebserkrankungen sind Metastasen für den Tod der Patienten verantwortlich: Vom Tumor trennen sich Tochtergeschwülste ab, verbreiten sich im Körper und wuchern an anderen Stellen weiter. In diesem Stadium ist die Krankheit kaum noch zu behandeln.
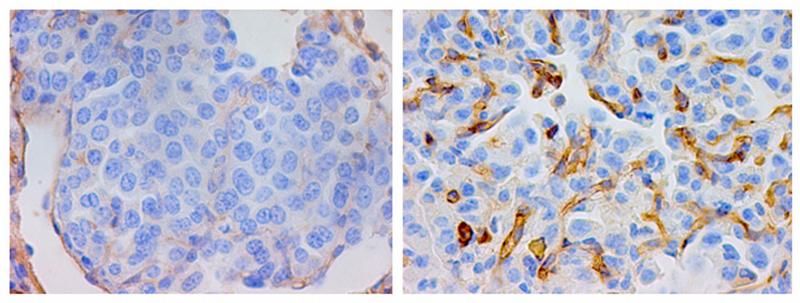
Diese Gewebeschnitte durch die Lungentumoren von Mäusen wurden mit CD31-Antikörpern angefärbt, um Blutgefäße darzustellen. Im rechten Bild ist zu sehen, wie der Verlust des Proteins E-Cadherin zur Neubildung zahlreicher Gefäße (rotbraun) führt.
Institut für Medizinische Strahlenkunde und Zellforschung
Was auf molekularer Ebene passiert, wenn ein Tumor zur Metastasierung übergeht, ist für viele Krebsarten nur wenig bekannt. Das gilt auch für Lungenkrebs. Ihn haben sich die Würzburger Forscher Rudolf Götz und Ulf R. Rapp vorgenommen. Die Forscher etablierten in genetisch veränderten Mäusen zuerst ein Modell für die häufigste Lungenkrebsform, das nichtkleinzellige Bronchialkarzinom. Wenn die Tiere zwei Wochen alt sind, entstehen bei ihnen automatisch gutartige, langsam wachsende Geschwülste, die sich im Lungengewebe ausbreiten, ohne es zu zerstören. Die Wissenschaftler brachten dann das harmlose Gewebe dazu, bösartig zu werden, und studierten diesen Vorgang mit Unterstützung von Kollegen aus der Kinderklinik und dem Anatomischen Institut.
Sie blockierten zuerst das Protein E-Cadherin, das für die Anheftung der Zellen auf Oberflächen wichtig ist. Dadurch kam es in der Geschwulst zu einer massiven Neubildung von Blutgefäßen - "und das war dann entscheidend für die folgende Metastasierung", erklärt Professor Rapp. Durch die intensivere Versorgung mit Blut wuchsen die Tumoren schneller, drangen ins umliegende Lungen-Gewebe ein und bildeten dort Metastasen. Lungentumor-Zellen nisteten sich auch in Lymphknoten und im Knochenmark ein.
In ihrem Artikel beschreiben die Würzburger detailliert, welche molekularen Vorgänge sie bei diesem Prozess beobachtet haben. Die verstärkte Blutgefäßbildung wird demzufolge durch den Wachstumsfaktor VEGF (Vascular Endothelial Growth Factor) ausgelöst, der zuvor über den ß-Catenin-Signalweg aktiviert wurde. "Unsere Ergebnisse legen nahe, dass die zunächst gutartigen Zellen durch die Inaktivierung des Proteins E-Cadherin neu programmiert worden sind. Das heißt, dass sie vorübergehend Eigenschaften eines anderen Zelltyps angenommen haben", so Rapp. Dabei handle es sich durchaus nicht um beliebige Eigenschaften. Vielmehr fallen die Lungenkrebszellen auf eine primitivere Entwicklungsstufe zurück: "Sie bekommen leberähnliche Eigenschaften und können darum in die Leber metastasieren", erklärt Rapp. Das sei möglich, weil bei der Entwicklung des Organismus sowohl die Lunge als auch die Leber aus ein und derselben Struktur gebildet werden: Beide entstehen als Ausstülpungen des so genannten Darmschlauchs.
Die Wissenschaftler planen jetzt, weitere Einzelheiten des Zusammenspiels verschiedener Signalwege bei der Tumorentstehung und Metastasierung zu entschlüsseln. Außerdem wollen sie natürlich Angriffspunkte finden, die für die Entwicklung zukünftiger molekularer Therapien wichtig sein könnten. Ihre Arbeiten werden von der Deutschen Krebshilfe und der Deutschen Forschungsgemeinschaft gefördert.
Originalveröffentlichung: Fatih Ceteci, Semra Ceteci, Christiaan Karreman, Boris W. Kramer, Esther Asan, Rudolf Götz, Ulf R. Rapp; "Disruption of Tumor Cell Adhesion Promotes Angiogenic Switch and Progression to Micrometastasis in RAF-Driven Murine Lung Cancer"; Cancer Cell 2007, 12, Seiten 145-159.
Meistgelesene News
Organisationen
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Ab sofort nichts mehr verpassen: Unser Newsletter für Biotechnologie, Pharma und Life Sciences bringt Sie jeden Dienstag und Donnerstag auf den neuesten Stand. Aktuelle Branchen-News, Produkt-Highlights und Innovationen - kompakt und verständlich in Ihrem Posteingang. Von uns recherchiert, damit Sie es nicht tun müssen.