Molekularer "Schutzengel" von Muskeln entdeckt
Einen zellulären Bewacher, der für den Erhalt und die Funktion von Muskeln sorgt, hat das Forschungsteam um Halyna Shcherbata am Göttinger Max-Planck-Institut für biophysikalische Chemie entdeckt. Wie die Wissenschaftler am Modell der Taufliege zeigen konnten, sind sogenannte mikroRNAs ein wichtiger Regulator des Muskelproteins Dystroglykan. Dieses spielt auch bei der Entstehung von Muskelerkrankungen, sogenannten Muskeldystrophien, eine Schlüsselrolle. Die Erkenntnisse der Forscher könnten dazu beitragen, neue Ansätze zur Behandlung derartiger Krankheiten zu entwickeln.
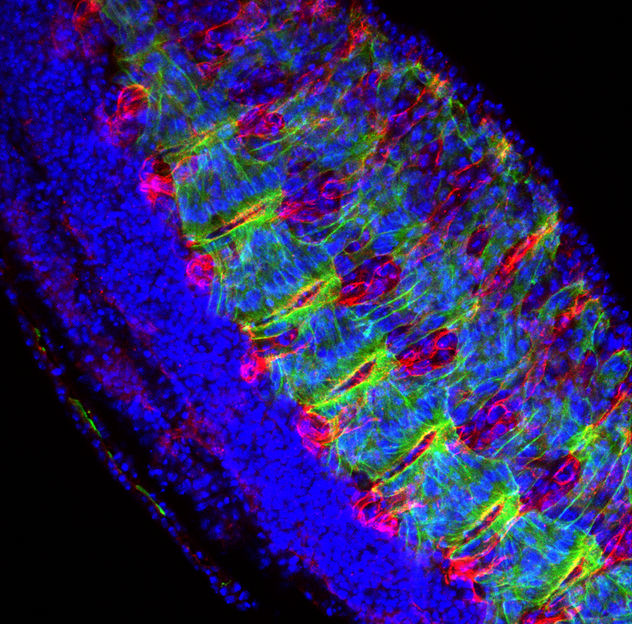
Mikroskopische Aufnahme eines Taufliegenembryos, in dem der molekulare „Schutzengel“ namens mikroRNA-9a „abgeschaltet“ wurde. Die Muskeln der Fliege (grün), das Muskelprotein Dystroglykan (rot) und die Zellkerne (blau) sind deutlich erkennbar.
© Shcherbata / Max-Planck-Institut für biophysikalische Chemie
Wenn Muskeln immer mehr an Masse und Kraft verlieren und sich ihr fortschreitender Schwund nicht aufhalten lässt, lautet die Diagnose: Muskeldystrophie. An diesen chronisch verlaufenden Erkrankungen der Skelettmuskulatur leiden allein in Deutschland etwa 30.000 Menschen. Ihre häufigste Ursache ist ein genetischer Defekt des sogenannten Dystrophin-Dystroglykan-Komplexes in der Membran der Skelettmuskelzellen. Er verbindet das Zytoskelett der Zelle mit ihrer Umgebung – der sogenannten extrazellulären Matrix. Auch Fliegen entwickeln Muskeldystrophien, wenn sie denselben genetischen Defekt aufweisen. Frühere Experimente der Forschungsgruppenleiterin Halyna Shcherbata vom Max-Planck-Institut für biophysikalische Chemie konnten dies eindeutig nachweisen. Bereits seit Längerem setzt die Wissenschaftlerin daher erfolgreich die Taufliege Drosophila melanogaster ein, um die Ursachen von Muskeldystrophien zu erforschen.
„Bei betroffenen Patienten scheinen neben dem Dystrophin-Dystroglykan-Komplex nicht zuletzt auch falsch geformte Verbindungen zwischen Sehnen und Muskeln für den Erhalt und die Funktion der Muskulatur eine wichtige Rolle zu spielen,“ erklärt Shcherbata. Die Muskel-Sehnen-Übergänge seien bisher in ihrer Bedeutung für Muskeldystrophien unterschätzt. Um neue Strategien zur Behandlung dieser Krankheiten zu entwickeln, ist es daher wichtig, die molekularen Mechanismen zu verstehen, die die Ausbildung der Muskel-Sehnen-Verbindungen steuern.
Einen molekularen „Schutzengel“ in diesem Prozess hat das Team um die Göttinger Entwicklungsbiologin jetzt in der Fliege identifiziert. Wie es herausfand, stellt dieser Beschützer – mikroRNA-9a (miR-9a) genannt – sicher, dass sich die Muskel-Sehnen-Übergänge normal ausbilden, indem es die Produktion störender Proteine verhindert. „Dystroglykan ist zwar für Muskelzellen unentbehrlich. Aber wenn es in den Sehnenzellen gebildet wird, hat das fatale Folgen,“ berichtet Shcherbata. „Wird dort das Dystroglykan-Gen fälschlicherweise „angeschaltet“, werden Muskeln und Sehnen nicht richtig verknüpft und in der frühen Entwicklung kann es zum Absterben der Embryonen kommen“. Ursache für solche fehlproduzierten Proteine sind zumeist Fehler beim Ablesen der Gene. Die Entdeckung der Göttinger Wissenschaftler, dass miRNAs ein wichtiger Regulator des Muskelproteins Dystroglykans sind, könnten möglicherweise auch neue Ansätze zur Behandlung von Muskeldystrophien eröffnen.
Wie die Entwicklungsbiologen herausfanden, wacht die miR-9a darüber hinaus noch über weitere Gene, die an der Bildung von Muskelzellen beteiligt sind. Dies fanden die Wissenschaftler mit einem raffinierten Experiment heraus. Dazu aktivierten die Forscher den molekularen „Schutzengel“ dort, wo er in der gesunden Fliege nicht aktiv ist: in embryonalem Gewebe, aus dem sich später auch die Skelettmuskulatur des Insekts entwickelt. Tatsächlich leistete die miR-9a auch am falschen Einsatzort ganze Arbeit – und verhinderte die Entwicklung jeglichen Muskelgewebes. „Wir vermuten daher, dass in der normalen Fliege die miR-9a das Anschalten einer ganzen Reihe störender muskelspezifischer Gene im Muskel-Sehnen-Übergang unterdrückt“, so Andriy Yatsenko, Postdoktorand in der Forschungsgruppe.
Doch wieso besteht überhaupt die Gefahr, dass in der Zelle Gene falsch abgelesen und Proteine produziert werden, die dieser im schlimmsten Fall sogar schaden? Die Antwort liefert ein Blick in die frühe Entwicklung lebender Organismen: Alle Gewebe des Körpers gehen aus den drei Keimblättern hervor: dem Endoderm, dem Ektoderm und später dem Mesoderm. Im Zuge der Bildung von Organen wandern Zellen auch zwischen Keimblättern, müssen aber in dieser fremden Umgebung ihre typischen Eigenschaften und Fähigkeiten als Leber-, Muskel, oder Herzzelle bewahren. Gleichzeitig ist wichtig, dass sie auf die Signale in ihrer neuen Umgebung richtig reagieren. Diese beiden Prozesse müssen kontinuierlich und genau ausbalanciert werden. Shcherbata erläutert: „miRNAs scheinen extrem wichtige Regulatoren zu sein, damit Zellen dieser Balanceakt gelingt. In unserem Fall sind die Sehnenzellen epidermalen Ursprungs, jedoch von mesodermalem Gewebe umgeben. Die miR-9a stellt sicher, dass jede Zelle – ob im Muskel-Sehnen-Übergang oder im umgebenden Gewebe – ihr typisches Repertoire an Proteinen erhält und so ihre Aufgaben erfüllen kann. Die miRNAs verleihen damit biologischen Systemen Stabilität und Robustheit gegenüber Fehlern oder zufälligen Schwankungen.“
Originalveröffentlichung
Andriy S. Yatsenko, Halyna R. Shcherbata. Drosophila miR-9a targets the ECM receptor dystroglycan to canalize myotendinous junction formation. Dev Cell 28, 335-348 (2014).