Tom22, der Türsteher am Mitochondrium
Freiburger Forscherin entdeckt drei Signalwege, die das Tor zum Inneren der Zellkraftwerke regulieren
Mitochondrien verbrennen Zucker und beliefern die Zelle mit Energie. Sie galten lange als von der Zelle stark unabhängige Bestandteile. Carolin Gerbeth, Doktorandin am trinationalen Graduiertenkolleg „Membrane proteins and biological membranes“, zeigt jedoch gleich drei Signalwege auf, mit denen die Zelle Einfluss auf Vorgänge im Mitochondrium nimmt. In der Bäckerhefe fand sie in Zusammenarbeit mit weiteren Kolleginnen und Kollegen der Universität Freiburg drei Enzyme, die den Transport von Proteinen in die Mitochondrien steuern. Das Team veröffentlichte die Ergebnisse in der Fachzeitschrift „Cell Metabolism“. „Unsere Arbeit bildet eine wichtige Grundlage, um solche Signalnetzwerke beim Menschen zu untersuchen und zu verstehen, welche Rolle sie bei der Entstehung von Krankheiten spielen. In Tumorzellen ist der mitochondriale Energiestoffwechsel fehlgesteuert und es ist denkbar, dass diese Umprogrammierung über die hier entdeckten Signalwege vermittelt wird“, erklärt Projektleiter Prof. Dr. Chris Meisinger, Exzellenzcluster BIOSS Centre for Biological Signalling Studies und Institut für Biochemie und Molekularbiologie der Universität Freiburg.
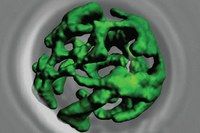
Angefärbte Mitochondrien in einer Bäckerhefezelle: Die Zelle steuert die Proteinzusammensetzung des Organells stärker als gedacht und kann auf diese Weise die Energieversorgung an die Umwelt anpassen.
© Rissler
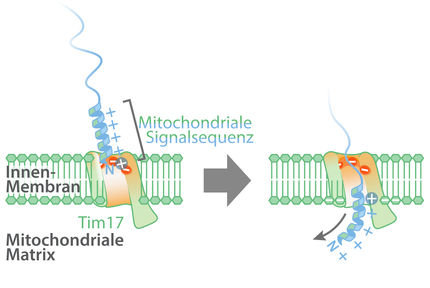
Mitochondrien ähneln einer Zelle in der Zelle: Vom Rest des Innenlebens durch zwei Membranen getrennt und mit eigenem Genom, ging man lange davon aus, dass sie zum Großteil unabhängig vom Zellkern reguliert werden. Allerdings werden die meisten Mitochondrien-Proteine von der DNA im Zellkern abgelesen und müssen nach ihrer Synthese im Cytosol, das die Zellkomponenten umgibt, in die Mitochondrien transportiert werden. Die Sortierung der Mitochondrien-Proteine nach ihrem Bestimmungsort muss jedoch genau sein. Nicht alles darf die Hülle der Zellkraftwerke passieren: Nur mit molekularer Postadresse kommt ein Protein durch die zentrale Eintrittspforte in der Außenmembran des Mitochondriums, den TOM-Komplex. Zusätzlich zur molekularen Pore Tom40 besteht der Komplex aus Rezeptoren wie Tom22, der wie ein Türsteher entscheidet, wer rein kommt und wer nicht. Das richtige Outfit ist der molekulare Aufbau der Proteine.
Nicht nur, dass die Proteine im Mitochondrium von außen kommen: Das Eintrittstor wird auch von Proteinen aus der Zelle gesteuert, fand Gerbeth heraus. Sie zeigte, dass zwei dieser so genannten Kinasen das Tor durchlässiger oder dichter machen können, indem sie ein Phosphat an den Vorläufer des Proteins Tom22 ankoppeln. Der Auslöser ist in diesem Fall der Zucker Glukose, den die Hefe als Nahrungsmittel und Energiespender verwendet. Die Hefezelle kann so den Energiestoffwechsel im Mitochondrium an die veränderte Umwelt anpassen. Wenn zum Beispiel Glukose im Überfluss vorhanden ist, lassen die Poren weniger Proteine durch, die zur Energiegewinnung notwendig sind – die Mitochondrien gehen in den Sparmodus und lassen die Zelle ihre Energie aus dem Cytosol beziehen. Eine der Kinasen ist sogar direkt in der Außenmembran eingebettet, gleich neben dem TOM-Komplex. Nur wenige Proteinkinasen wurden bisher in Mitochondrien entdeckt.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Polyethersulfone Ultrafilter von Sartorius
Zuverlässige Filtration mit PESU-Membranen
Perfekt für Biotechnologie und Pharma, widersteht Sterilisation und hohen Temperaturen

Hydrosart® Microfilter von Sartorius
Hydrophile Mikrofilter für Bioprozesse
Minimale Proteinadsorption und hohe Durchflussraten

Sartobind® Rapid A von Sartorius
Effiziente Chromatographie mit Einweg-Membranen
Steigern Sie die Produktivität und senken Sie Kosten mit schnellen Zykluszeiten

Sartopore® Platinum von Sartorius
Effiziente Filtration mit minimaler Proteinadsorption
Reduziert Spülvolumen um 95 % und bietet 1 m² Filtrationsfläche pro 10"

Hydrosart® Ultrafilter von Sartorius
Effiziente Ultrafiltration für Biotech und Pharma
Maximale Durchflussraten und minimaler Proteinverlust mit Hydrosart®-Membranen

Polyethersulfone Microfilter von Sartorius
Biotechnologische Filtration leicht gemacht
Hochstabile 0,1 µm PESU-Membranen für maximale Effizienz

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Ab sofort nichts mehr verpassen: Unser Newsletter für Biotechnologie, Pharma und Life Sciences bringt Sie jeden Dienstag und Donnerstag auf den neuesten Stand. Aktuelle Branchen-News, Produkt-Highlights und Innovationen - kompakt und verständlich in Ihrem Posteingang. Von uns recherchiert, damit Sie es nicht tun müssen.