Neue Werkzeuge gegen Krankenhausinfektionen?
Eingekapseltes Peptid blockiert Kommunikation und Virulenz resistenter Staphylokokken
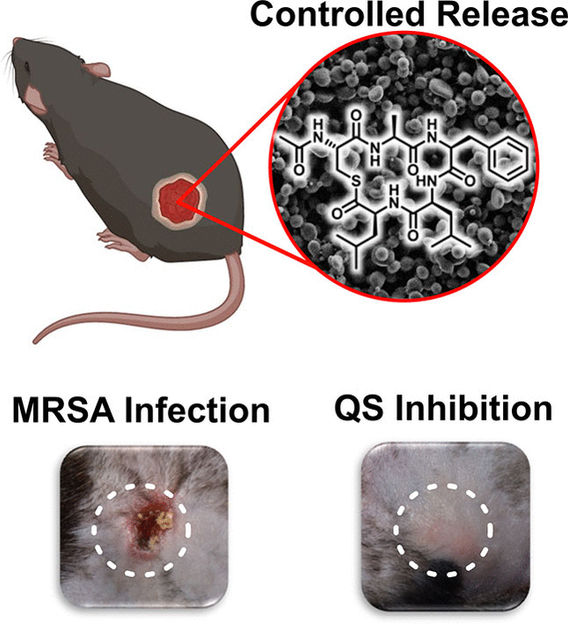
Antibiotika-resistente Krankenhauskeime sind eine nicht zu unterschätzende Gesundheitsgefahr. Einen neuen Ansatz für die Behandlung von Infektionen mit multiresistenten Staphylokokken stellt ein Forschungsteam jetzt in der Zeitschrift Angewandte Chemie vor. Er basiert auf einem synthetischen Peptid, das die Kommunikation der Bakterien, das „Quorum Sensing“, blockiert und so deren Virulenz verringert. Die kontrollierte Freisetzung des Wirkstoffs aus abbaubaren Mikropartikeln konnte Infektionen von Hautwunden in einem Tier-Modell sehr stark hemmen.
© Wiley-VCH
Im Krankenhaus sollte man gesund werden und nicht durch eine der gefürchteten Krankenhausinfektionen noch kränker. Die für Gesunde oft harmlosen Erreger können sehr gefährlich werden, wenn sie in (OP-)Wunden oder z.B. bei Untersuchungen ins Körperinnere geschwächter Patienten gelangen. Alarmstufe rot gilt bei multiresistenten Bakterien wie dem Methicillin-resistenten Staphylococcus aureus (MRSA), gegen den praktisch kein Antibiotikum mehr wirkt. In den USA gehen jährlich ca. 100.000 Krankenhausinfektionen mit fast 20.000 Todesfällen auf dessen Konto.
Je mehr Antibiotika, desto mehr Resistenzen: Die aufkommende Antibiotika-Krise lässt sich nur durch alternative Ansätze meistern. So zielen „Anti-Virulenz“-Strategien darauf ab, die Infektionskraft des Erregers zu verringern, ohne ihn abzutöten. Dadurch verringert sich der Selektionsdruck, der zur Entwicklung von Resistenzen führt. Da die Schwere der Infektion abnimmt, kann im Idealfall die Immunabwehr des Patienten die Infektion besiegen.
Als Angriffspunkt für ihren Anti-Virulenz-Ansatz gegen S. aureus wählte das interdisziplinäre Team von der University of Wisconsin-Madison (USA) um Helen E. Blackwell ein chemisches Kommunikationssytem der Bakterien untereinander, das Quorum Sensing (QS). Viele Pathogene verwenden QS, um die Produktion von Virulenzfaktoren oder an Infektionen beteiligte Toxine zu regulieren. Virulenzfaktoren verleihen Erregern u.a. die Fähigkeit, an Wirtszellen zu haften und in sie einzudringen.
Der QS-Regelkreis von S. aureus und verwandten Bakterien basiert auf dem „Accessory Gene Regulator“ (agr)-System. Als Signalmolekül dient das „Autoinducing Peptide“ (AIP). Das Forschungsteam entwickelte ein AIP-ähnliches synthetisches Peptid, das das agr-System außergewöhnlich stark blockiert und damit auch das QS. Das Weglassen eines Peptid-Endstücks im Vergleich zu AIP verlangsamt den Abbau des Inhibitor-Peptids im Gewebe deutlich. Durch Einkapselung in bioabbaubare Polymer-Mikropartikel lässt sich die Freisetzung zudem verzögern und die Wirkung erheblich verlängern, sodass eine hohe Wirksamkeit bei geringer Dosis erzielbar ist. In einem Mäusemodell für Haut-Abszesse ließen sich Infektionen mit S. aureus durch eine lokale Injektion des eingekapselten Peptids fast vollständig blockieren.
Das neue Inhibitor-Peptid könnte einen Ansatz für therapeutische Strategien gegen bakterielle Infektionen sowie Erkenntnisse über die Rolle von agr und QS bei chronischen Infektionen liefern. Zudem könnte es eine Grundlage für die Entwicklung von Oberflächenbeschichtungen sein, die bakterielle Infektionen hemmen, z.B. für Implantate.
Originalveröffentlichung
Meistgelesene News
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Ab sofort nichts mehr verpassen: Unser Newsletter für Biotechnologie, Pharma und Life Sciences bringt Sie jeden Dienstag und Donnerstag auf den neuesten Stand. Aktuelle Branchen-News, Produkt-Highlights und Innovationen - kompakt und verständlich in Ihrem Posteingang. Von uns recherchiert, damit Sie es nicht tun müssen.