Mit molekularem Daumenkino Listerien auf der Spur
Wissenschaftler des HZI klären die Signalwege auf, mit denen sich Listerien in unseren Darm einschleusen
Listerien sind allgegenwärtige, meist harmlose Bakterien. Schwere Infektionen verursachen sie nur dann, wenn es ihnen gelingt, die äußeren Barrieren unseres Immunsystems zu durchbrechen: Gelegentlich gelangen sie mit verdorbenen Lebensmitteln in unseren Darm, umgehen dort unsere Sicherheitssysteme und können – einmal im Blutstrom angelangt – die Leber, das Gehirn oder bei Schwangeren den Fötus infizieren. In der Fachzeitschrift "Molecular and Cellular Proteomics" zeigen jetzt Lothar Jänsch und sein Mitarbeiter Tobias Reinl vom Helmholtz-Zentrum für Infektionsforschung (HZI) in Braunschweig, welche Kommunikationsmechanismen Listeria monocytogenes einsetzt, um in unseren Körper einzuwandern.
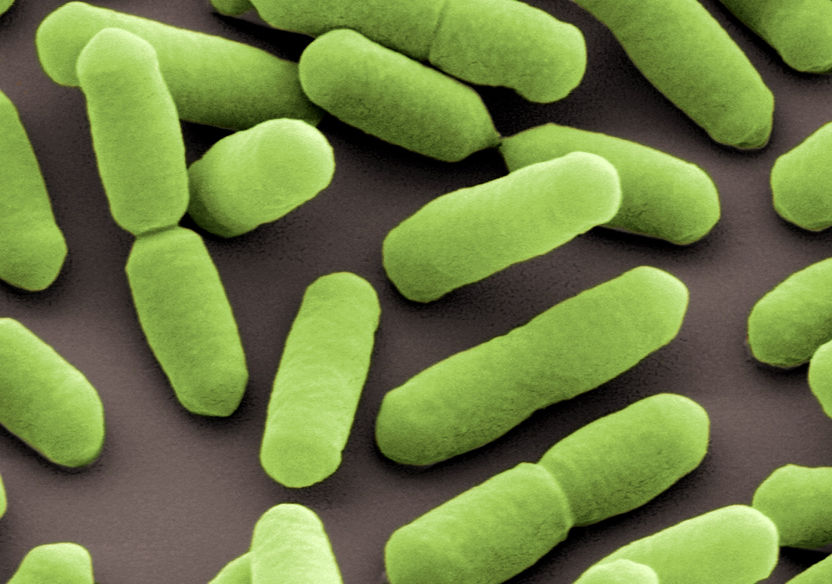
Eine elektronenmikroskopische Aufnahme von Listeria monocytogenes.
(c) Helmholtz-Zentrum für Infektionsforschung, Braunschweig
Der Trick der Listerien: Sie täuschen vor, eine körpereigene Zelle oder ein Wachstumsfaktor zu sein. Dafür binden sie mit bestimmten Eiweißstoffen, den Internalinen, an die passenden Rezeptoren unserer Barrierezellen. So aktiviert, programmieren die Rezeptoren nun die Signalwege im Zellinneren um. Mit der Folge, dass unsere körpereigenen Zellen die Listeria-Bakterien in sich aufnehmen.
Eine wichtige Substanzklasse, die Listerien nach dem Andocken im Zellinneren aktivieren, sind die Kinasen. Diese Proteine sind darauf spezialisiert, Signale innerhalb der Zelle weiter zu reichen. Dazu fügen sie mit einer einfachen chemischen Reaktion kleine strukturelle Veränderungen – so genannte Phosphorylierungen – in andere Proteine ein. Die chemische Reaktion pflanzt sich wie eine Signalkaskade innerhalb der Zelle von Protein zu Protein fort. Die Zellen verändern sich schließlich derart, dass sie ihre Barrierefunktion verlieren und die Listerien in das Körperinnere eindringen können.
„Wir möchten verstehen, wie die Signalwege in den menschlichen Barrierezellen nach dem Andocken der Listerien im Detail ablaufen“, sagt Lothar Jänsch. Die HZI-Wissenschaftler haben deshalb eine neue Analysemethode entwickelt: „Wir machen Momentaufnahmen vom Infektionsprozess, sobald das Internalin der Listerien die Rezeptoren auf den Barrierezellen aktiviert hat. An ihnen können wir ablesen, welche Kinasen an der Signalweitergabe beteiligt sind.“
Zu Beginn der Untersuchung aktiviert HZI-Wissenschaftler Tobias Reinl in einem Laborgefäß Barrierezellen mit Internalin – der Andocksubstanz der Listerien. Zu einem bestimmten Zeitpunkt, etwa nach vier Minuten, unterbricht er die Signalkaskade, indem er die Zellen in flüssigem Stickstoff schockfrostet. Die Momentaufnahme ist zur Untersuchung fertig. Im Anschluss analysieren Lother Jänsch und Tobias Reinl, welche der insgesamt 500 in den Zellen vorkommenden Kinasen an der Signalweitergabe beteiligt sind: Mit einer als quantitativer Massenspektroskopie bezeichneten Technik bestimmen sie deren Phosphorylierungsmuster und vergleichen es mit dem unbehandelter Zellen. So können Reinl und Jänsch genau ablesen, welche Kinasen im Augenblick der Schockfrostung gerade Signale in der Zelle weitergeben.
In Zukunft wollen die HZI-Wissenschaftler den Zustand der Kinasen zu verschiedenen Zeitpunkten untersuchen. „So bekommen wir eine Art `molekulares Daumenkino`– eine Aufnahmeserie an der wir genau ablesen können, woher ein Signal kommt und in welche Richtung es weitergegeben wird.“ Dadurch, dass Lother Jänsch und Tobias Reinl fast alle Kinasen, die für die Invasion eine Rolle spielen, gleichzeitig untersuchen können, können sie die Gesamtheit der Signalpfade nachvollziehen. „Und das ist letztlich die Basis, um die Kommunikation in den Barrierezellen zu blockieren und so Therapeutika gegen diese Art von Infektionen entwickeln“, schließt Lothar Jänsch.
Originalveröffentlichung: Reinl T et al.; "Quantitative phosphokinome analysis of the Met pathway activated by the invasin InlB from listeria monocytogenes"; Mol Cell Proteomics 2009 Jul 29. [Epub ahead of print] M800521-MCP200