Comment un organite évolue-t-il ?
Des organismes unicellulaires indépendants aux organites cellulaires
À l'origine, les organites cellulaires étaient souvent des cellules indépendantes, qui ont été incorporées par des cellules hôtes et ont perdu leur indépendance au cours de l'évolution. Une équipe de biologistes dirigée par le professeur Eva Nowack de l'université Heinrich Heine de Düsseldorf (HHU) étudie la manière dont ce processus d'assimilation se déroule et à quelle vitesse. Ils décrivent aujourd'hui leurs découvertes concernant une étape intermédiaire de ce processus dans la revue scientifique Science Advances.

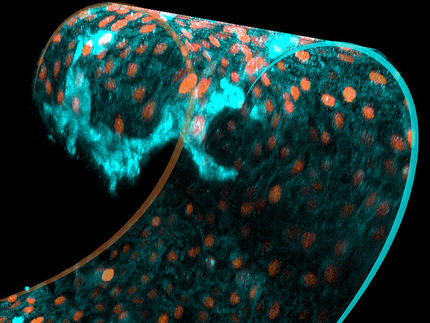
Chez la trypanosomatide Angomonas deanei, l'endosymbionte se divise de manière synchrone avec la cellule hôte. La protéine ETP9 codée par le noyau est essentielle pour la division de l'endosymbionte.
HHU/Anay Maurya and Eva Nowack
Les cellules eucaryotes - c'est-à-dire les cellules dotées d'un noyau - contiennent un grand nombre de sous-unités fonctionnelles, appelées organites. Elles remplissent des fonctions importantes au sein de la cellule. Certains organites ont été des organismes unicellulaires indépendants à un moment donné dans le passé. Ils ont ensuite été absorbés par une cellule et ont évolué au fil du temps en symbiose avec la cellule hôte. Ces "endosymbiontes" ont perdu leur capacité à fonctionner de manière autonome au cours de ce processus. Un exemple bien connu de ce type d'organite est la mitochondrie - la "centrale électrique de la cellule" - qui a évolué à partir d'une bactérie.
Le groupe de travail dirigé par le professeur Nowack à l'Institut de biologie cellulaire microbienne étudie comment les cellules et leurs endosymbiontes se sont adaptés et ont évolué en symbiose les uns avec les autres au cours de millions d'années. Une publication, qui vient de paraître dans la revue scientifique "Science Advances", porte sur la trypanosomatide Angomonas deanei (en abrégé : A. deanei), un flagellé unicellulaire de la sous-famille des Strigomonadinae. Ces organismes vivent dans les intestins des insectes.
Professeur Nowack : "Tous les membres de la sous-famille des Strigomonadinae ont un endosymbionte. Il y a environ 40 à 120 millions d'années, un ancêtre commun des Strigomonadinae actuels a absorbé une protobactérie, à partir de laquelle l'endosymbionte a évolué". Il fournit à ses cellules hôtes des métabolites et ce que l'on appelle des cofacteurs, qui ont par exemple une fonction catalytique dans les enzymes. "Il est intéressant de noter que chaque cellule hôte ne possède qu'un seul de ces endosymbiontes, qui se divise toujours de manière synchrone avec la cellule hôte", ajoute M. Nowack.
En 2022, l'équipe de recherche basée à Düsseldorf a rapporté dans "Current Biology" que plusieurs protéines produites par la cellule hôte interagissent avec l'endosymbionte. L'une de ces protéines, appelée ETP9, forme un anneau autour du site de division de l'endosymbionte. Les chercheurs travaillant avec le professeur Nowack et son doctorant Anay Maurya ont maintenant découvert que les endosymbiontes des Strigomonadinae - qui étaient autrefois des bactéries indépendantes - ont perdu pratiquement tous les gènes nécessaires à la division. Le gène, qui décrit la protéine FtsZ et marque le site de division dans les bactéries et la plupart des organites, est l'un des rares gènes de division cellulaire bactérienne restants.
Maurya, membre de l'école doctorale Manchot "Molecules of Infection IV" et auteur principal de l'étude : "Contrôlée depuis le noyau cellulaire, la protéine ETP9 s'accumule sur le site de division de l'endosymbionte selon un processus dépendant du cycle cellulaire. Lorsque nous arrêtons expérimentalement la production d'ETP9, l'endosymbionte ne peut plus se diviser. De longs endosymbiontes filiformes apparaissent, dans lesquels la protéine bactérienne FtsZ marque maintenant plusieurs sites de division, mais ils ne peuvent plus se diviser sans l'aide de la protéine hôte ETP9".
L'endosymbionte d'A. deanei représente donc un stade intermédiaire entre une bactérie endosymbiotique - qui est encore génétiquement autonome - et un organite, qui est presque entièrement contrôlé par la cellule hôte. L'endosymbionte a perdu des gènes essentiels à sa survie autonome. Les gènes présents dans le noyau de la cellule hôte ont maintenant remplacé leurs fonctions.
Nowack : "Ces résultats fondamentaux nous aident à comprendre comment un organite évolue à partir d'une bactérie. Grâce à ce mécanisme, il sera peut-être possible à l'avenir de développer une symbiose synthétique dans laquelle les endosymbiontes synthétiques seront contrôlés par le noyau de la cellule."
Les biologistes de l'Institut de biologie cellulaire microbienne ont mené leurs travaux de recherche en collaboration avec l'Institut de microbiologie médicale et d'hygiène hospitalière de l'HHU (équipe de recherche dirigée par le professeur Dr Stefanie Scheu) et le Centre d'imagerie avancée.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.