Qu'est-ce qui déclenche le mécanisme de mort cellulaire programmée ?
Développement et combinaison de diverses techniques microscopiques et spectroscopiques
Comment analyser les structures moléculaires lorsque la résolution des techniques disponibles n'est pas suffisante ? Des chercheurs en physique, chimie et médecine de l'université Heinrich Heine de Düsseldorf (HHU) ont combiné et perfectionné diverses techniques microscopiques et spectroscopiques afin d'examiner un arrangement protéique dans la membrane cellulaire qui joue un rôle important dans la "mort cellulaire programmée". Dans la revue scientifique Science Advances, ils décrivent maintenant les circonstances dans lesquelles le récepteur CD95, responsable de la mort cellulaire, réagit.
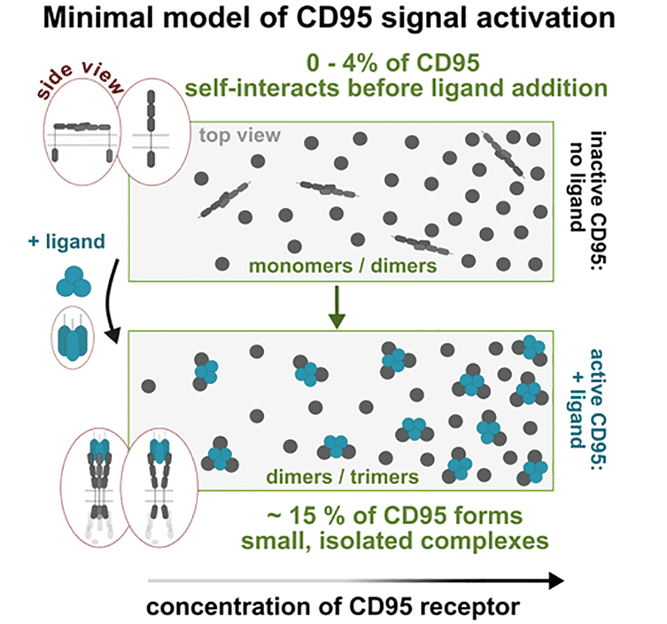
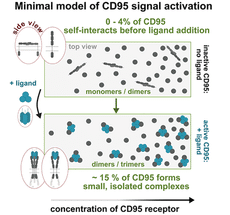
Modèle d'activation du signal résultant des mesures : Après interaction avec le ligand CD95, le récepteur CD95 modifie son arrangement et sa conformation, ce qui entraîne la formation de petits complexes protéiques.
HHU / Cornelia Monzel
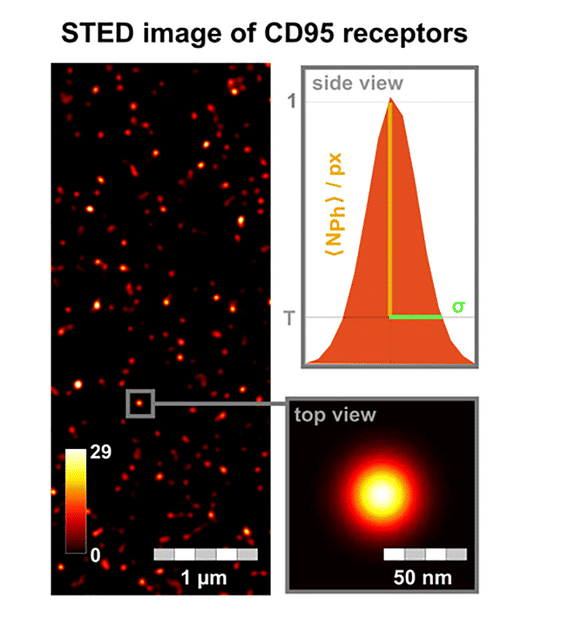
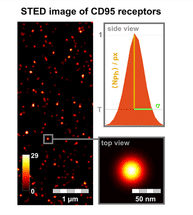
Image STED des récepteurs CD95 sur la membrane cellulaire. Pour chaque point de récepteur fluorescent, la luminosité (nombre de photons par pixel) et l'écart-type de la taille du point (σ) sont analysés. Outre l'utilisation de la microscopie STED, la spectroscopie d'image par transfert d'énergie par résonance de Förster (FRET) et l'analyse de l'étape de photoblanchiment ont été développées plus avant.
HHU / Cornelia Monzel
Dans les cellules biologiques, la grande majorité des structures fonctionnelles sont constituées de molécules de protéines. Pour comprendre la fonction des protéines, il faut connaître leur structure tridimensionnelle. Il est également important d'enregistrer leur disposition spatiale et leur interaction dynamique entre elles et avec d'autres protéines dans leur environnement immédiat et plus large, car ces facteurs déclenchent souvent leur fonction.
L'obtention de ces informations est très complexe et ces mesures sont en partie à la limite de ce qui est techniquement possible. Comme les structures protéiques concernées ne mesurent souvent qu'un à 100 nanomètres (nm ; un milliardième de mètre), elles ne peuvent pas être résolues à l'aide de microscopes optiques conventionnels. Les techniques avancées à haute résolution, telles que la "microscopie à déplétion par émission stimulée" (en abrégé : microscopie STED), récompensée par le prix Nobel de chimie en 2014, ne sont pas non plus suffisantes à elles seules.
Une équipe de recherche dirigée par le professeur Dr Cornelia Monzel (Institut de physique médicale expérimentale) et le professeur Dr Claus A. M. Seidel (Chaire de chimie physique moléculaire) a désormais combiné différentes techniques afin de comprendre le mode de fonctionnement du récepteur CD95 à la surface des membranes cellulaires. L'objectif était de déterminer l'arrangement moléculaire complet et l'interaction du récepteur nécessaire pour déclencher un signal cellulaire.
Le récepteur CD95 est d'une importance fondamentale pour les cellules : Le signal qui conduit finalement à la mort cellulaire contrôlée ou programmée - l'"apoptose" - est déclenché par l'intermédiaire de cette protéine. Le professeur Monzel, l'un des deux auteurs correspondants de l'étude : "Au quotidien, cette voie de signalisation est responsable du fait que nous ne grandissons pas constamment en veillant à ce qu'autant de cellules existantes meurent que de nouvelles sont créées. Elle joue également un rôle important dans de nombreux autres processus tels que le développement des êtres vivants, la cicatrisation des plaies et la thérapie du cancer."
Ce récepteur ne mesure qu'environ 20 nm. Le Dr Nina Bartels, l'un des deux principaux auteurs de l'étude, qui vient d'être publiée dans Science Advances, a déclaré "Comme nous ne pouvons pas résoudre directement et clairement ces minuscules structures à l'aide de techniques à haute résolution, nous avons dû développer diverses techniques microscopiques et spectroscopiques et les combiner.
Outre la microscopie STED, qui permet de résoudre des structures de 40 nm, les chercheurs de Düsseldorf ont également développé la spectroscopie d'image par transfert d'énergie de résonance de Förster (FRET) et l'analyse de l'étape de photoblanchiment. Ils peuvent ainsi mesurer le nombre, la distribution et l'interaction des récepteurs sur la membrane jusqu'à quelques nanomètres.
Nicolaas van der Voort, deuxième auteur principal de l'étude : "Nos mesures nous ont permis de développer un modèle clair des processus nécessaires à l'activation du récepteur CD95 et donc à la mort cellulaire contrôlée. Pour activer le signal de mort cellulaire, 15 % seulement de tous les récepteurs CD95 présents sur la membrane cellulaire doivent se lier par deux ou trois à une autre protéine, appelée ligand CD95."
Le professeur Seidel, l'autre auteur correspondant de l'étude, souligne les aspects plus larges des résultats de la recherche : "Outre les découvertes relatives à l'activation de la mort cellulaire contrôlée, ce travail décrit d'importantes avancées microscopiques et spectroscopiques, qui peuvent être transférées à de nombreuses autres questions biologiques et médicales."
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.
Publication originale
Nina Bartels, Nicolaas T. M. van der Voort, Oleg Opanasyuk, Suren Felekyan, Annemarie Greife, Xiaoyue Shang, Arthur Bister, Constanze Wiek, Claus A. M. Seidel, Cornelia Monzel; "Advanced multiparametric image spectroscopy and super-resolution microscopy reveal a minimal model of CD95 signal initiation"; Science Advances, Volume 10