Des enzymes alimentées par la lumière pour produire de l'ammoniac
Les scientifiques examinent comment les systèmes moléculaires composés de nanocristaux et de protéines favorisent la production d'ammoniac à l'aide de la lumière.
L'atmosphère terrestre contient de grandes quantités d'azote sous forme de diazote gazeux (N2). La transformation du N2 en Ammoniac (NH3) est essentielle à la fabrication des engrais nécessaires à l'agriculture. Actuellement, la production d'ammoniac nécessite 2 % de l'énergie mondiale et génère d'importants gaz à effet de serre. Dans la nature, l'enzyme nitrogenase peut catalyser la production d'ammoniac en utilisant l'énergie stockée dans l'adénosine triphosphate (ATP) pour entraîner la réaction. L'ATP est une molécule naturelle présente dans toutes les formes de vie. Il est possible de remplacer l'ATP par l'énergie solaire pour un processus à faible consommation d'énergie qui ne produit pas de gaz à effet de serre. Cependant, les chercheurs sont encore en train de développer ces processus basés sur la lumière du soleil. Dans cette recherche, les scientifiques ont créé un biohybride unique qui couple des nanocristaux à la nitrogénase. Les nanocristaux utilisent la lumière du soleil pour transférer la charge aux enzymes et achever la réaction. La recherche a permis d'identifier les propriétés des nanocristaux pour se lier à la nitrogénase, ce qui a aidé les scientifiques à mieux comprendre cette réaction complexe de production de NH3.
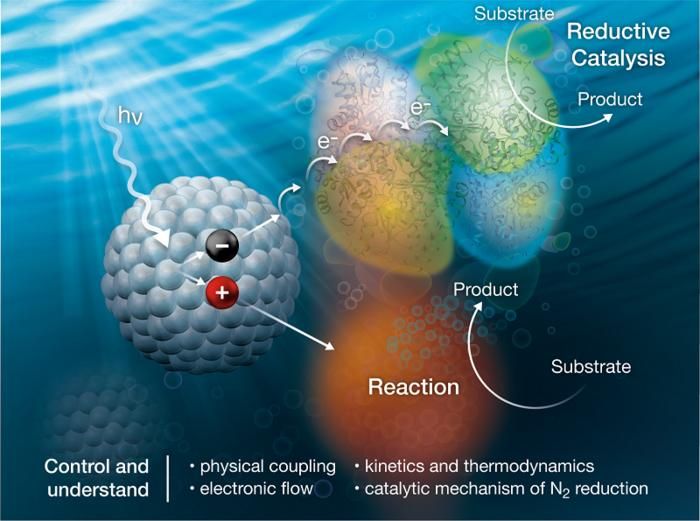
Les nanocristaux (à gauche) captent la lumière (hv) et transfèrent ensuite des électrons (e-) aux enzymes de la nitrogénase (en haut à droite) pour convertir le diazote (N2) en ammoniac (NH3). Une réaction sacrificielle (en bas à droite) complète le processus.
Image courtesy of Alfred Hicks, National Renewable Energy Laboratory.
Cette approche biohybride utilise la lumière du soleil pour entraîner les réactions de conversion exigeantes en énergie qui peuvent atténuer la coproduction de gaz à effet de serre. La méthode standard de fabrication de l'ammoniac est le procédé Haber-Bosch. Ce procédé produit environ 150 millions de tonnes métriques (MmT) d'ammoniac par an, mais il nécessite de grandes quantités d'énergie et produit également environ 280 MmT de dioxyde de carbone (CO2). Le nouveau procédé utilise la lumière du soleil pour catalyser la production de NH3 sans générer deCO2. Il s'agit également d'un moyen intéressant de produire des engrais NH3 à proximité de l'endroit où ils seront utilisés, minimisant ainsi les émissions deCO2 dues au transport vers les exploitations agricoles. Pour que ce processus devienne réalité, il faut comprendre comment coupler la lumière du soleil pour conduire la réaction.
Pour produire de l'ammoniac en utilisant la lumière du soleil, les chercheurs ont mis au point un système biohybride composé de nanocristaux et de l'enzyme Mo-nitrogenase. Cette enzyme possède un groupe métallique unique, appelé cofacteur FeMo-, qui nécessite huit électrons et huit protons pour réduire le N2 en ammoniac. Les chercheurs ont utilisé ce système nanocristal/enzyme pour déterminer comment diriger les électrons photogénérés vers le cofacteur FeMo- et pour étudier le mécanisme correspondant. Pour que le système repose sur la lumière, la nanoparticule et l'enzyme doivent être chimiquement compatibles et former un complexe réactionnel stable. Cette recherche a exploré la manière de fabriquer des nanoparticules qui se lient à l'enzyme.
Cette approche donne un aperçu de la manière d'ajuster synthétiquement les nanocristaux pour qu'ils se lient aux enzymes et transfèrent la charge de manière sélective. Grâce à ces progrès, les chercheurs peuvent étudier le processus en détail. À l'état congelé, les intermédiaires réactionnels du cofacteur FeMo peuvent être piégés et analysés en détail par des techniques de spectroscopie de résonance paramagnétique électronique. Cette base technique permet aux chercheurs d'identifier les intermédiaires réactionnels, les énergies d'activation des étapes réactionnelles et l'évolution d'un modèle cinétique de la réaction de réduction du N2.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.



















































