Empêcher les cellules cancéreuses de coloniser le foie
Les nouvelles découvertes permettront de mettre au point de futurs traitements susceptibles d'empêcher la formation de métastases souvent fatales
Des chercheurs de l'ETH Zurich ont découvert comment les cellules cancéreuses colorectales colonisent le foie. Leurs découvertes pourraient ouvrir la voie à de nouveaux moyens de supprimer ce processus à l'avenir.
Dans les cas où le cancer est mortel, neuf fois sur dix, le coupable est une métastase. C'est le cas lorsque la tumeur primaire a envoyé des cellules, comme des graines, et a envahi d'autres organes du corps. Si la médecine a fait de grands progrès dans le traitement des tumeurs primaires, elle est encore largement impuissante face aux métastases. À l'heure actuelle, il n'existe aucun médicament capable de prévenir ce processus.
Une équipe de chercheurs dirigée par Andreas Moor, du département de science et d'ingénierie des biosystèmes de l'ETH Zurich à Bâle, vient de publier dans la revue Nature des résultats montrant comment les cellules cancéreuses colorectales colonisent le foie. Leurs conclusions contribueront à la mise au point de traitements permettant d'entraver le processus métastatique.
Le mécanisme d'arrimage moléculaire débloqué
On dit d'un cancer qu'il forme des métastases lorsque des cellules de la tumeur primaire se détachent et se déplacent vers d'autres parties du corps par le biais du système circulatoire. "Le cancer colorectal se métastase dans le foie en raison de la manière dont le sang circule", explique M. Moor. Le sang est d'abord enrichi en nutriments dans les intestins avant d'être acheminé vers le foie, qui métabolise les nutriments. Pour les cellules cancéreuses colorectales, le foie est la dernière étape. "Elles se retrouvent coincées dans le réseau capillaire du foie", explique M. Moor.
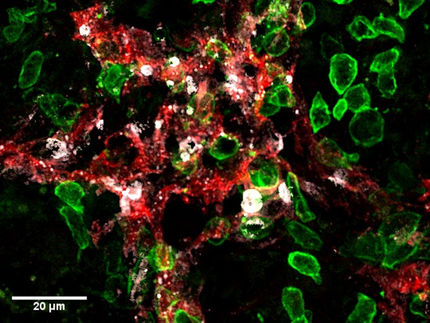
Costanza Borrelli, étudiante en doctorat, et d'autres membres de l'équipe de Moor ont maintenant montré que les cellules du foie jouent également un rôle important dans la capacité des cellules cancéreuses qui y sont logées à coloniser leur nouvel emplacement. La science sait depuis plus d'un siècle que les cellules cancéreuses dépendent de leur environnement, à l'instar des graines de plantes dans le sol, mais on ignorait jusqu'à présent quels mécanismes moléculaires jouaient un rôle à cet égard.
En utilisant des tests sophistiqués sur des souris génétiquement modifiées, Moor et son équipe ont découvert que le secret réside dans certaines protéines à la surface des cellules. Lorsque les cellules hépatiques possèdent une protéine appelée Plexine-B2 et que les cellules cancéreuses colorectales possèdent certaines protéines de la famille des sémaphorines, les cellules cancéreuses colorectales peuvent s'attacher aux cellules hépatiques.
Signaux dans le système nerveux
Les cellules cancéreuses qui possèdent des sémaphorines à leur surface sont particulièrement dangereuses, comme l'attestent les études cliniques citées par les chercheurs de Moor dans leur article. Les données de l'étude montrent que le cancer colorectal métastase plus tôt et plus fréquemment dans le foie si la tumeur contient de grandes quantités de sémaphorine.
La plexine et son homologue, la sémaphorine, étaient auparavant connues de la communauté des chercheurs pour leur fonction dans le système nerveux, où les deux protéines orientent les cellules nerveuses en croissance et veillent à ce qu'elles forment les bonnes voies. "La raison pour laquelle les cellules hépatiques créent également de la plexine et ce que fait cette protéine dans les foies sains n'est pas du tout clair et nous intéresse au plus haut point", explique M. Moor. En d'autres termes, la question de sa fonction reste ouverte.
Retour à la sédentarité
Moor et son équipe ont toutefois découvert que le contact direct entre la plexine et la sémaphorine déclenche des changements fondamentaux dans les cellules cancéreuses colorectales. Pour se détacher de la tumeur primaire, les cellules cancéreuses doivent changer d'identité : elles se libèrent de la couche superficielle de l'intestin, ou épithélium, et rompent leurs liens étroits avec les cellules voisines.
Une fois dans la circulation sanguine, les cellules cancéreuses ressemblent à celles d'un tissu conjonctif appelé mésenchyme. Mais une fois qu'elles ont trouvé leur nouvelle niche - grâce à la plexine présente sur certaines cellules du foie - les cellules cancéreuses reprennent leur forme sédentaire. "Un processus d'épithélisation se met en place", écrivent les chercheurs dans leur article. Moor développe : "On peut le remarquer immédiatement en observant les cellules cancéreuses, car elles forment des invaginations semblables aux plis ou aux cryptes de l'intestin."
Une période critique
La découverte des chercheurs n'aura pas seulement un impact sur les patients atteints de cancer colorectal : d'autres tests ont montré que la plexine favorise également la formation de métastases dans le mélanome et le cancer du pancréas. Pour Moor et son équipe, cette découverte soulève de nombreuses nouvelles questions de recherche. L'une d'entre elles retient particulièrement leur attention : lorsque les cellules cancéreuses se regroupent pour former une tumeur, elles influencent également les cellules de leur environnement. "Les cellules cancéreuses créent leur propre écosystème", explique Moor.
Si les efforts visant à inhiber l'interaction cruciale entre la plexine et la sémaphorine aboutissent, il pourrait être possible d'empêcher le cancer de créer de nouvelles tumeurs. En effet, au début, lorsque les relations entre les cellules de cet écosystème ne sont pas encore fermement établies, les métastases tumorales sont particulièrement vulnérables, explique Moor. Il est persuadé qu'une réponse se trouve dans cette "période critique du développement des métastases", même si le chemin vers un traitement potentiel est encore long.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.
Publication originale
Costanza Borrelli, Morgan Roberts, Davide Eletto, Marie-Didiée Hussherr, Hassan Fazilaty, Tomas Valenta, Atefeh Lafzi, Jonas A. Kretz, Elena Guido Vinzoni, Andromachi Karakatsani, Srivathsan Adivarahan, Ardian Mannhart, Shoichiro Kimura, Ab Meijs, Farah Baccouche Mhamedi, Ilhan E. Acar, Kristina Handler, Xenia Ficht, Randall J. Platt, Salvatore Piscuoglio, Andreas E. Moor; "In vivo interaction screening reveals liver-derived constraints to metastasis"; Nature, 2024-7-24