Faire tourner les usines de protéines - Comment les enzymes de déubiquitinisation se transforment en protéases Fubi
Des chercheurs de Max Planck identifient les mécanismes des acteurs clés du processus de maturation des ribosomes à l'aide d'un kit d'outils de biologie chimique
La petite protéine ubiquitine est particulièrement connue pour marquer les protéines en vue de leur dégradation, mais il a également été démontré qu'elle régule pratiquement tous les processus cellulaires. Parallèlement au système d'ubiquitine, divers autres modificateurs de type ubiquitine ont évolué, parmi lesquels Fubi est particulièrement peu étudié malgré son activité immunomodulatrice. Les scientifiques de Malte Gersch, chef du groupe de recherche au Centre de génomique chimique de l'Institut Max Planck de physiologie moléculaire, ont maintenant obtenu les premières informations moléculaires sur la machinerie facilitant la maturation contrôlée par Fubi d'une protéine clé du ribosome, l'usine à protéines de la cellule. À l'aide d'un nouveau kit d'outils chimiques, les chercheurs ont caractérisé la manière dont deux enzymes de déubiquitinisation fournissent une activité hydrolase spécifique à Fubi et se transforment ainsi en protéases de Fubi à deux niveaux.
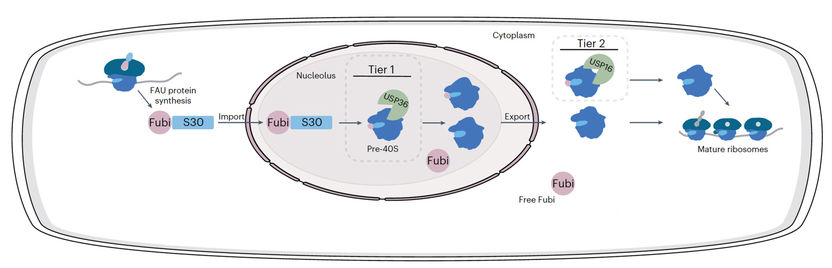
Représentation schématique du traitement à deux niveaux proposé pour Fubi-S30 et le système Fubi.
MPI für molekulare Physiologie
Le Fubi est produit par les cellules en tant que protéine de fusion avec la protéine ribosomique S30, et doit être séparé de la S30 par des protéases pour que les ribosomes fonctionnent. Dans les cellules immunitaires, ce sous-produit de la production de ribosomes est utilisé comme molécule de signalisation sécrétée, par exemple pour réduire localement l'activité du système immunitaire maternel dans l'utérus et permettre ainsi aux embryons de s'implanter. La manière dont Fubi est spécifiquement reconnu par les protéases et dont elles le distinguent de l'ubiquitine était jusqu'à présent inconnue.
Rachel O'Dea et Malte Gersch, premier auteur, expliquent leur recherche en détail :
Quelle est la découverte que vous avez faite et pourquoi est-elle passionnante ?
"Notre équipe a révélé comment deux enzymes de désubiquitinisation peuvent également agir en tant que protéases de la protéine Fubi semblable à l'ubiquitine et a obtenu des informations moléculaires sur la manière dont cela est possible de manière spécifique. Cette découverte est remarquable car, malgré la similitude entre l'ubiquitine et les protéines de type ubiquitine, les enzymes qui les régulent chez l'homme ne sont généralement pas les mêmes. Nous montrons que cette double activité est spécifique aux deux enzymes USP16 et USP36 et nos études cristallographiques expliquent mécaniquement comment cette rare réactivité croisée est obtenue. De manière surprenante, contrairement à ce qui est observé dans les enzymes à réactivité croisée des bactéries ou des virus, nous n'avons pas trouvé d'éléments structuraux supplémentaires qui facilitent l'activité Fubi supplémentaire de ces protéases d'ubiquitine bien caractérisées. Au lieu de cela, la reconnaissance de Fubi est médiée par un petit motif cryptique sur une surface de liaison complémentaire".
Quelle est la particularité de la trousse d'outils que vous avez mise au point ?
"Peut-être en raison de la difficulté de sa composition en acides aminés, les outils de la protéine Fubi n'avaient pas encore été ajoutés au répertoire des outils d'étude de l'ubiquitine et des protéines similaires à l'ubiquitine. Notre travail démontre des approches faciles pour fabriquer des outils Fubi qui peuvent être facilement adaptés par d'autres scientifiques dans ce domaine. Les sondes et le substrat fluorescent Fubi décrits ici permettent d'évaluer l'activité de l'effaceur Fubi dans des environnements cellulaires et in vitro.
Pourquoi votre recherche est-elle importante pour la communauté scientifique ?
"Notre travail fournit de nouvelles informations moléculaires sur la façon dont les enzymes peuvent avoir des activités couvrant plusieurs systèmes de modification. En expliquant comment USP16 et USP36 jouent un rôle dans la maturation des protéines ribosomiques, nous comprenons mieux les mécanismes qui régulent ce processus cellulaire essentiel. Fubi a été principalement étudié par des scientifiques du domaine de l'immunologie et, plus récemment, du domaine des ribosomes, et notre approche du sujet avec l'arrière-plan de l'ubiquitine complète ces autres travaux. L'ensemble des données converge vers un modèle à deux niveaux pour le traitement des Fubi".
Pourquoi votre recherche est-elle importante pour la société ?
"En raison de leur nature rapide et réversible, les modifications post-traductionnelles telles que l'ubiquitine et les protéines de type ubiquitine sont des régulateurs essentiels de la quasi-totalité des processus cellulaires. Fubi a été associé à des fonctions immunomodulatrices et il a été démontré qu'il modifie les protéines au cours des réponses de stimulation immunitaire. La compréhension du rôle exact de Fubi dans ce processus nous permettra de mieux comprendre comment les cellules répondent à la signalisation immunitaire.
Quelles sont les prochaines étapes ?
"Nos connaissances sur la reconnaissance de Fubi permettent de régler l'activité de la protéase Fubi dans les cellules et ouvrent ainsi la voie à une meilleure compréhension du rôle cellulaire de cette protéine énigmatique en tant que modification post-traductionnelle. En outre, nous utilisons les sondes pour faciliter l'étude du mécanisme moléculaire par lequel d'autres protéines interagissent avec Fubi. Mais d'abord, nous allons faire la fête".
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.




































