Un nouveau talon d'Achille de la paroi cellulaire bactérienne
Comment une seule protéine régulatrice agit comme un outil multiple de remodelage de la paroi cellulaire bactérienne : Un nouvel espoir contre les infections bactériennes
La paroi cellulaire bactérienne doit être constamment remodelée pour pouvoir croître et se diviser. Cela implique une coordination étroite entre les enzymes lytiques (autolysines) et la synthèse du peptidoglycane. Des chercheurs dirigés par le professeur Martin Thanbichler ont découvert qu'un régulateur central peut contrôler des classes d'autolysines complètement différentes. Étant donné que de nombreux antibiotiques ciblent la paroi cellulaire bactérienne, ces résultats pourraient contribuer au développement de nouvelles stratégies thérapeutiques contre les infections bactériennes.
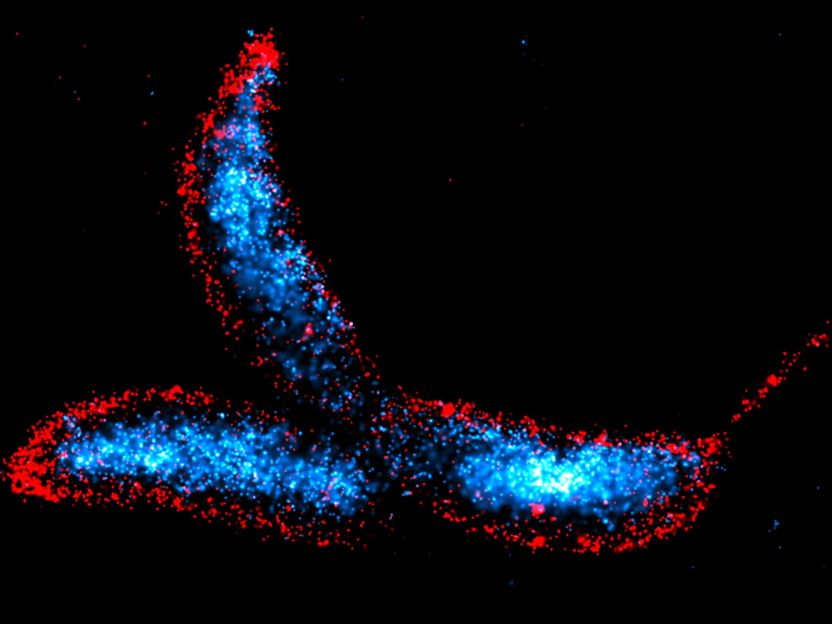
Caulobacter crescentus est une bactérie dimorphique en forme de croissant qui constitue l'un des principaux organismes modèles pour l'étude de la régulation du cycle cellulaire bactérien, de la différenciation cellulaire et de la morphogenèse. Les cellules ont été visualisées à l'aide de la technique DNA-PAINT, l'ADN chromosomique étant coloré en bleu et les membranes cellulaires en rouge.
© Max Planck Institute for Terrestrial Microbiology/Hernandez-Tamayo
Au cours de l'évolution, les cellules ont développé un large éventail de stratégies pour renforcer leur enveloppe contre la pression osmotique interne, ce qui leur permet de se développer dans une variété d'environnements différents. La plupart des espèces bactériennes synthétisent une paroi cellulaire semi-rigide entourant la membrane cytoplasmique, dont le principal composant, le peptidoglycane, forme un maillage dense qui enveloppe la cellule. Outre son rôle protecteur, la paroi cellulaire sert également à générer des formes cellulaires spécifiques, telles que des sphères, des bâtonnets ou des spirales, facilitant ainsi la motilité, la colonisation des surfaces et la pathogénicité.
La présence d'une paroi cellulaire présente ses propres défis : les cellules doivent constamment la remodeler pour croître et se diviser. Pour ce faire, elles doivent très soigneusement créer des déchirures dans la paroi pour lui permettre de s'étendre et de se modifier, tout en réparant rapidement les lacunes avec du nouveau matériel pour éviter qu'elle ne s'effondre. Ce processus de remodelage de la paroi cellulaire implique le clivage des liaisons par des enzymes lytiques, également connues sous le nom d'autolysines, et l'insertion ultérieure de nouveaux matériaux de la paroi cellulaire par des peptidoglycanes synthases. Les activités de ces deux groupes de protéines antagonistes doivent être étroitement coordonnées pour éviter les faiblesses de la couche de peptidoglycane qui entraînent la lyse et la mort de la cellule.
L'équipe de recherche dirigée par Martin Thanbichler, titulaire d'une bourse Max Planck à l'Institut Max Planck de microbiologie terrestre et professeur de microbiologie à l'université de Marburg, a entrepris de découvrir la composition et la fonction de la machinerie autolytique. Leurs études se concentrent sur la bactérie en forme de croissant Caulobacter crescentus, que l'on trouve dans les environnements d'eau douce et qui est largement utilisée comme organisme modèle pour étudier les processus cellulaires fondamentaux des bactéries.
Selon Martin Thanbichler, l'étude de la fonction des autolysines a été une tâche difficile. "Alors que nous en savons beaucoup sur la machinerie synthétique, les autolysines se sont révélées être un problème difficile à résoudre. Maria Billini, chercheuse postdoctorale dans l'équipe de Martin Thanbichler, ajoute : "Les bactéries abritent généralement de nombreux types d'autolysines appartenant à des familles d'enzymes différentes et ayant des cibles différentes. Cela signifie que ces protéines sont très redondantes et que la suppression de gènes d'autolysine individuels a souvent peu d'effet sur la morphologie et la croissance des cellules."
L'analyse des régulateurs potentiels des autolysines par criblage par co-immunoprécipitation et essais d'interaction protéine-protéine in vitro a révélé qu'un facteur appelé DipM joue un rôle central dans le remodelage de la paroi cellulaire bactérienne. Ce régulateur clé, une protéine soluble périplasmique, interagit de manière surprenante avec plusieurs classes d'autolysines ainsi qu'avec un facteur de division cellulaire, montrant une promiscuité jusqu'alors inconnue pour ce type de régulateur. DipM a été capable de stimuler l'activité de deux enzymes de clivage du peptidoglycane ayant des activités et des repliements complètement différents, ce qui en fait le premier régulateur identifié capable de contrôler deux classes d'autolysines. Les résultats indiquent également que DipM utilise une interface unique pour interagir avec ses différentes cibles.
"La perturbation de DipM entraîne une perte de régulation à différents points du processus de division et de remodelage de la paroi cellulaire et finit par tuer la cellule", explique le doctorant Adrian Izquierdo Martinez, premier auteur de l'étude. "Sa fonction de coordinateur de l'activité de l'autolysine est donc essentielle au maintien de la forme et de la division des cellules chez C. crescentus.
La caractérisation complète de DipM a révélé un nouveau réseau d'interaction, y compris une boucle d'auto-renforcement qui relie les transglycosylases lytiques et peut-être d'autres autolysines au cœur de l'appareil de division cellulaire de C. crescentus, et très probablement aussi d'autres bactéries. Ainsi, DipM coordonne un réseau complexe d'autolysines dont la topologie diffère grandement de celle des systèmes d'autolysines précédemment étudiés. Martin Thanbichler souligne : "L'étude de ces régulateurs multi-enzymes, dont le dysfonctionnement affecte simultanément plusieurs processus liés à la paroi cellulaire, ne nous aide pas seulement à comprendre comment la paroi cellulaire réagit aux changements dans la cellule ou dans l'environnement. Elle peut également contribuer au développement de nouvelles stratégies thérapeutiques qui combattent les bactéries en perturbant simultanément plusieurs voies autolytiques. "
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.